中国科学院物理研究所/北京凝聚态物理国家研究中心软物质实验室SM1组的李伟副研究员长期从事单分子力谱技术的发展和应用,与生物学家合作在染色质动态结构和调控方面取得了一系列重要的进展(Molecular Cell 2016,2018)。最近,与首都医科大学陈萍教授课题组以及生物物理所李国红研究员课题组合作,在国际上首次测量了组蛋白H2AK119泛素修饰对核小体结构的影响,并且建立了单分子系统实时观察去泛素酶USP21敲去泛素的逆过程。利用刚刚建立的基于GPU计算的高通量高分辨单分子磁镊力谱技术,解析了组蛋白H2AK119位置的单泛素修饰能够锁定DNA剥离,将核小体自由能从30kJ/mol降低至200kJ/mol,极大的增强了核小体结构的稳定性。并且,进一步确定出一个H2AK119泛素修饰负责锁定半圈核小体DNA。这部分工作直接回答了H2AK119泛素修饰在基因沉默方面发挥作用的分子机理。最后,他们实时再现了去泛素酶USP21结合核小体上,敲去H2AK119泛素的动态过程,进一步证明了组蛋白H2A泛素修饰通过锁定DNA,阻止DNA从组蛋白八聚体上剥离,完成基因沉默的功能。相关工作发表在2020年JACS期刊,并被推荐为Top5%文章。
中科院物理研究所软物质物理实验室的李伟副研究员和首都医科大学的陈萍教授为文章的共同通讯作者,物理研究所博士研究生肖雪、生物物理所刘翠芳助理研究员及生物物理研究所硕士研究生裴迎新为共同第一作者。该工作得到了国家自然科学基金委、科技部和中科院前沿重点项目的资助。
文章链接:https://pubs.acs.org/doi/10.1021/jacs.9b12448
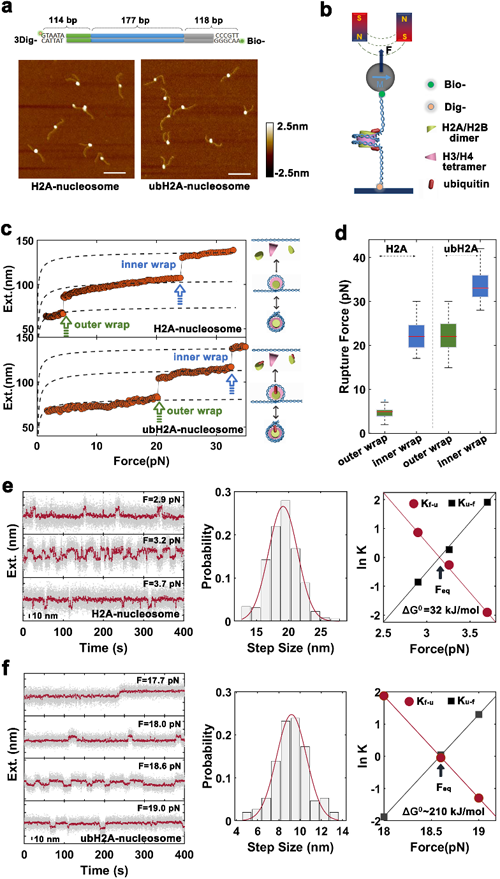 |
| 图1. 单分子力谱技术解析H2A泛素增强核小体力学稳定性。(a)核小体AFM图像。(b)磁镊示意图。(c)常规核小体(上)和泛素核小体的拆解动力学。(d)拆解外力统计。(e)常规核小体折叠去折叠动态结构恒力跟踪。(f)泛素核小体折叠去折叠动态结构恒力跟踪。 |
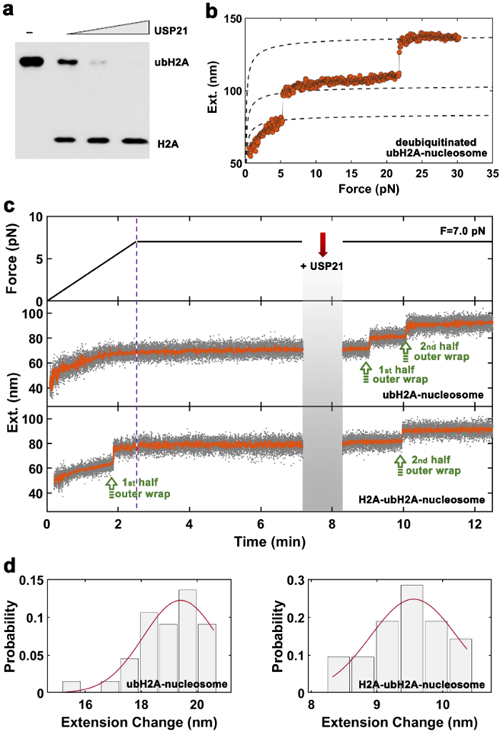 |
| 图2.去泛素酶USP21结合核小体动力学过程。(a)USP21结合组蛋白H2A胶图。(b)USP21处理后的核小体回归常规核小体状态。(c)USP21结合双泛素(上)和单泛素核小体(下)动力学过程。 |
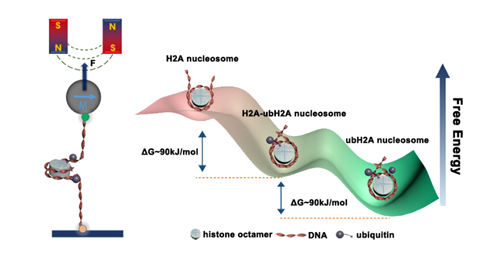 |
| 图3.泛素修饰增强核小体力学稳定性,实现基因沉默的调控功能。 |
2020 Histone H2A Ubiquitination Reinforces Mechanical Stability and Asymmetry at the Single-Nucleosome Level JACS.pdf
