

北京师范大学 化学学院, 北京 100875
2019-07-04 收稿, 2019-07-08 录用
*通讯作者: 邹应全, E-mail: zouyq@263.net
摘要: 本文从光活性高的3,4-乙烯二氧噻吩(EDOT)出发,在其两个活性位点上分别引入了一个乙酰基噻吩基团和一个乙酰基基团,合成了一种结构新颖的、适用于UV-LED光固化体系的光引发剂2-(2-乙酰基噻吩)-5-乙酰基-3,4-乙烯二氧噻吩(S-2)。利用核磁共振氢谱对其结构进行了表征,并测试了其紫外吸收特性和热稳定性,还利用实时红外技术对其光引发活性进行了测试。结果表明,此光引发剂在365~405 nm范围内有较好的吸收,其紫外吸收性能和热稳定性优于异丙基硫杂蒽酮(ITX),光引发活性与ITX相当。
关键词: UV-LED光引发剂3, 4-乙烯二氧噻吩(EDOT)自由基光聚合
Preparation and Properties of New Photoinitiator for UV-LED Photo Source
PANG Yulian, ZHAO Liying, GAO Ming, ZOU Yingquan


College of Chemistry, Beijing Normal University, Beijing 100875, P. R. China
*Corresponding author: ZOU Yingquan, E-mail: zouyq@263.net
Abstract: One photoinitiator based on the 3, 4-ethylenedioxythiophene (EDOT) was synthesized through introducing an acetylehienyl and an acetyl group respectively into two active sites of the EDOT. The structure was characterized by 1HNMR spectroscopy. UV-Vis absorption spectroscopy, thermal stability were also tested. We also measured its photoinitiating activity with real-time FTIR technology. The results show that the photoinitiator has good absorption in the range of 365-405 nm, which is better than 2-isopropylthioxanthone(ITX) and suitable for UV-LED photocuring systems. Meanwhile, its thermal stability is better than ITX and the photoinitiating activity is comparable to ITX.
Key words: UV-LEDphotoinitiatorEDOTradical photopolymerization
近年来,UV-LED固化技术因具有高效、节能、环保的特点,成为光固化技术的发展方向[1, 2]。但是,UV-LED固化技术仍然面临着诸多挑战[3]:其一,由于UV-LED灯发出的是单色光,波峰狭窄,辐射的能量集中在狭窄的紫外光谱段,故UV-LED固化也只能集中在紫外光谱中一个狭窄的范围。目前UV-LED固化光源的波长包括365、375、385、395和405 nm,每种波长光源的发射谱带宽度大约为10 nm,而市场上大多数光引发剂是在300~370 nm波长范围内有较强的吸收,在λ>370 nm的范围内吸光性能比较差,这就导致UV-LED固化体系中光源的发射光谱与传统光引发剂的吸收光谱不相匹配,最终影响光引发剂的引发效率。其二,由于UV-LED灯功率小(尤其是短波UV-LED),输出光强较弱,发光效率低,所以光引发剂对其敏感度较低,影响光引发剂引发光化学反应的量子效率,因而降低了光引发剂的引发效率。由于在传统光引发剂中只有少数的特征吸收波长可与UV-LED光源的发射波长相匹配,使得UV-LED光源在传统光固化体系中的应用受到很大限制。想在UV固化领域中推广使用UV-LED光源,就必须研发出更多针对UV-LED固化体系的高效光引发剂。
开发新型的UV-LED光引发剂,需满足以下几个方面的要求[4]:光引发剂的吸收光谱与UV-LED光源的发射光谱相互匹配;具有高活性中间体量子产率(即要产生足够数量的引发活性较高的活性物种);光引发剂在单体及树脂中的溶解性好,热稳定性及在配方体系中的存储性好,低毒性、低迁移率、低气味、耐黄变等。
本文的目的在于研发一种适用于UV-LED固化体系的结构新颖、高敏感度、低毒性等综合性能良好的光引发剂。研究发现在光引发剂结构中引入N原子或S原子可以起到增感作用和抗氧干扰的作用,而且相对于N原子而言,S原子的抗氧干扰的能力更强[5]。此外,由于传统的光引发剂大多是基于芳香结构体系的化合物,毒性较大,因此本文选择毒性较小的含有五元杂环噻吩的3, 4-乙撑二氧噻吩(EDOT)做为生色团。3, 4-乙撑二氧噻吩(EDOT)作为一种富电子的化合物,电活性较高,被广泛用于合成导电聚合物,其相应的光活性也很高[6-12]。若在EDOT结构基础上引入其他不饱和基团扩大其共轭体系,使其吸收波长能够与UV-LED光源的辐射波长相匹配,那么在UV-LED光照的条件下,该类化合物就能够容易裂解或夺氢,产生活性中间体自由基,从而引发光固化体系中的单体和低聚物聚合固化。基于以上发现,本文设计合成了一种基于EDOT结构的新型光引发剂2-(2-乙酰基噻吩)-5-乙酰基-3, 4-乙烯二氧噻吩(S-2,结构见式 1),并对其性能进行了研究。
式 1
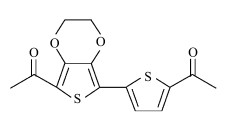 | 式 1 S-2结构 Structure of S-2 |
1 实验部分1.1 主要试剂3, 4-乙烯二氧噻吩(EDOT,99%), 上海阿达玛斯试剂有限公司;无水四氯化锡(分析纯), 山东西亚化学工业有限公司;2-乙酰基-5-溴噻吩购(99%)、四三苯基膦钯(98%)、醋酸钯(98%), 均购于Alfa Aesar(天津)化学有限公司;乙酸酐(分析纯)、醋酸钾(分析纯)、四丁基溴化铵(分析纯), 均购于北京伊诺凯科技有限公司;N, N-二甲基甲酰胺(分析纯)、碳酸钾(分析纯)、乙酸乙酯(分析纯)、石油醚(分析纯)、二氯甲烷(分析纯)、无水硫酸钠(分析纯)、乙腈(分析纯)、碳酸氢钠(分析纯)、甲基丙烯酸羟乙酯(HEMA)(分析纯), 北京蓝弋化工产品有限责任公司产品。
1.2 基于EDOT结构的新型光引发剂S-2的制备中间产物2-(2-乙酰基噻吩)-3, 4-乙烯二氧噻吩(S-1)的合成是通过钯催化3, 4-乙烯二氧噻吩(EDOT)与2-乙酰基-5-溴噻吩的交叉耦合得以实现。将KOAc(29.40 g, 0.3 mol)和TBAB(32.24 g, 0.1 mol)加入盛有N, N-二甲基甲酰胺(200 mL)的500 mL四口瓶中,搅拌均匀后,将3, 4-乙烯二氧噻吩(EDOT)(14.24 g, 0.1 mol)、2-乙酰基-5-溴噻吩(20.50 g, 0.1 mol)和催化剂Pd(OAc)2(2.24 g, 0.01 mol)依次加入反应液中,然后于80 ℃下搅拌反应6 h。待反应液的温度降至室温,倒入50 mL水中,用50 mL二氯甲烷萃取3次,水洗有机相至pH=7,然后用无水硫酸钠干燥,过滤,旋蒸除去有机相。最后,选用柱层析法(展开剂选用V乙酸乙酯 : V石油醚=1 : 5)进一步纯化得到10.64 g中间产物S-1,为淡黄色絮状物,产率40%。1HNMR(400 MHz, CDCl3):2.55(s, 3H), 4.25~4.27(dd, 2H), 4.36~4.38(dd, 2H), 6.34(s, 1H), 7.18~7.19(d, 1H), 7.58~7.59(d, 1H)。
将中间产物S-1(3.22 g, 0.01 mol)加入盛有100 mL二氯甲烷的250 mL四口瓶中,搅拌均匀后加入乙酸酐(1.02 g, 0.01 mol)的二氯甲烷溶液(10 mL),再次搅拌均匀后,加入SnCl4(2.61 g, 0.01 mol)的无水乙腈溶液(50 mL),于25 ℃下搅拌反应6 h。反应完全后,将反应液倒入适量冰水中将反应淬灭,待水相和有机相分层后,弃去水相,将有机相依次用饱和碳酸氢钠水溶液和水进行洗涤,然后用无水硫酸钠干燥,过滤,减压蒸馏除去有机相,得到粗产物。最后,选用柱层析法(展开剂选用V二氯甲烷:V乙酸乙酯:V石油醚=20:1:5)进一步纯化得到1.8 g终产物S-2,为黄色絮状物,产率60%。1HNMR(400 MHz, CDCl3):2.54(s, 3H), 2.56(s, 3H), 4.42~4.43(dd, 2H), 4.44~4.45(dd, 2H), 7.33~7.34(d, 1H), 7.60~7.61(d, 1H)。
S-2合成路线见式 2。
式 2
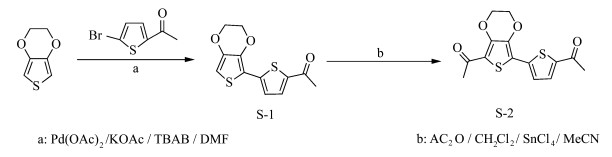 | 式 2 S-2合成路线 Synthesis process of S-2 |
1.3 表征方法1.3.1 化合物结构表征使用德国Bruker公司Avame PRX400核磁共振仪对化合物进行了核磁共振氢谱测定,确定其分子结构,测试所用内标物为四甲基硅烷(TMS), 溶剂为氘代氯仿(CDCl3)。
1.3.2 紫外光谱分析使用日本岛津公司UV-2450紫外可见分光光度计测定样品的紫外-可见吸收光谱。将目标产物溶于乙腈配置成浓度为1.05×10-4 mol/L的溶液进行测定。
1.3.3 热稳定性分析利用美国TA公司Q2000热重分析仪对不同光固化配方进行热稳定性分析,升温区间为50~800 ℃,升温速率为10 ℃/min,载气为氮气。
1.3.4 光引发性能分析利用实时红外技术,对合成的新型光引发剂S-2与异丙基硫杂蒽酮(ITX)及二苯甲酮(BP)进行了光引发性能方面的比较。通过美国Nicolet公司Nicolet 5700 FT-IR(实时红外光谱仪)测试丙烯酸酯双键的转化率,辐照光源为紫外点光源S2000并配置320~500 nm滤光片(EXFO公司,加拿大)。固定样品中心光源强度为30 mW/cm2,设定固化时间为900 s,光谱的扫描范围为500~4000 cm-1。
将上述3种光引发剂分别与单体甲基丙烯酸羟乙酯(HEMA)配置成引发剂质量浓度为0.02%的试样,涂于KBr盐片上,再用另一片大小合适的KBr盐片覆盖到已涂有试样的盐片上,制成双盐片用于无氧测试。然后,将制备好的双盐片试样放入实时红外仪的样品槽处,用事先调好的光强为30 mW/cm2的紫外光(光强由Honle UV光强计测得)照射到样品上,使样品发生光聚合反应。聚合体系中的HEMA单体的双键转化率用近红外实时采集,实时红外参数设置为:数据采集间隔0.3985 s,每个光谱扫描4次,分辨率为4 cm-1。在近红外谱图中,单体HEMA的C=C键的特征吸收峰在1630 cm-1处,随着光聚合反应的进行,C=C键逐渐转变为C-C键,相应的,双键的吸收峰强度随光照时间的增加而逐渐变弱,因此,可以利用C=C的特征吸收峰的变化来反映聚合反应的进行程度。双键转化率(DC)由红外软件OMNIC7.1和数据处理软件Origin8.0结合公式DC(%)=[1-(At/A0)]×100%计算得到。式中,A0和At分别为光照前和光照后t时刻样品中HEMA单体在1630 cm-1处的双键特征吸收峰的面积。
2 结果与讨论2.1 紫外吸收特性图 1为S-2、ITX及BP的紫外-可见吸收光谱图。由图 1可见,BP在365~405 nm范围内几乎无吸收,ITX在此范围内有一定吸收,最大吸收波长为384 nm,对应的最大摩尔消光系数为4.65×103 L·mol-1·cm-1。S-2在365~405 nm的波长范围内有较强的吸收,其最大吸收波长为375 nm,对应的最大摩尔消光系数为2.79×104 L·mol-1·cm-1。其在384 nm对应的摩尔消光系数为2.52×104 L·mol-1·cm-1,为ITX在384 nm处最大摩尔消光系数的5.4倍。另据表 1可知,相较于ITX,其在365、375、385、395及405 nm处均具有较大的摩尔消光系数,在365~395 nm之间的摩尔消光系数是ITX的5倍以上。由此可见,目标光引发剂S-2的紫外吸收性能优于ITX,其吸收光谱能够与365~405 nm范围内的UV-LED光源的发射光谱很好地匹配,可适用于365~405 nm范围内的UV-LED光固化体系中。
图 1
 | 图 1 目标光引发剂S-2的紫外-可见光吸收光谱图 The ultraviolet-visible absorption spectra of target photoinitiator S-2 |
表1
| 表 1 S-2与ITX在365、375、385、395和405 nm处的摩尔消光系数 Molar extinction coefficient of S-2 and ITX at 365, 375, 385, 395, and 405 nm |
2.2 热稳定性图 2为ITX和S-2的热分解曲线(TG曲线)及热分解速率曲线(DTG)。由这两种化合物的TG曲线可以看出,合成的新型光引发剂S-2的初始分解温度为180 ℃,商业光引发剂ITX的初始分解温度在160 ℃。若以物质重量变化速率最快的地方所对应的温度来考察物质的分解温度,则由这两种化合物的DTG曲线可以看出,S-2的分解温度达到316 ℃,ITX的分解温度在245 ℃。由此可见,光引发剂S-2的热稳定性优于ITX的热稳定性。
图 2
 | 图 2 ITX、S-2的TG和DTG曲线 The curves of thermal decomposition of ITX and target product S-2 |
2.3 光引发性能图 3为相同质量浓度(0.02%)的3种不同的光引发剂(S-2、ITX、BP)引发HEMA聚合的双键转化率随时间变化的曲线图。
图 3
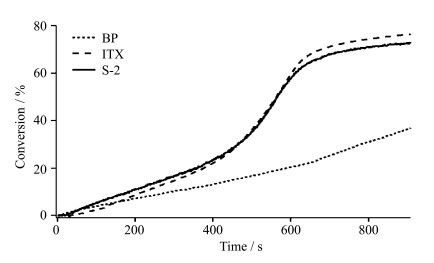 | 图 3 相同质量浓度(0.02%)的不同光引发剂引发HEMA单体聚合的双键转化率曲线 Double bond conversion curve for HEMA monomer polymerization initiated by different photoinitiators at the same concentration (0.02%) |
由图 3可以看出,目标光引发剂S-2的引发效率与异丙基硫杂蒽酮(ITX)的引发效率相当,在无氧条件下,在质量浓度很低的情况下(0.02%)都可以使单体聚合的双键转化率达到70%以上,高于二苯甲酮(BP)同等条件下的引发效率(40%)。
图 4为相同质量浓度(0.02%)的不同光引发剂引发HEMA单体聚合的双键反应速率曲线。由图 4可以看出,3种自由基光引发剂在400 s之前反应速率都比较低,这是因为在聚合初期,体系消耗阻聚杂质,反应速度较慢,曲线变化缓慢。但是在辐照400 s之后S-2和ITX的反应速率迅速变快,二者分别在542 s和548 s处达到最大聚合反应速率。这是因为聚合反应达到中期阶段,引发剂分解生成的自由基主要用于引发聚合,反应速率较快。在聚合反应后期,随着单体浓度下降,反应速率逐渐变慢,曲线又变平缓[13]。而BP自始至终反应速率均较低,是因为其在320 nm以后紫外吸收非常低,光能利用率较低所致。由此可见,目标光引发剂S-2不仅在引发效率方面与异丙基硫杂蒽(ITX)相当,二者引发HEMA的反应速率也相似,均远远高于二苯甲酮(BP)同等条件下的引发速率。
图 4
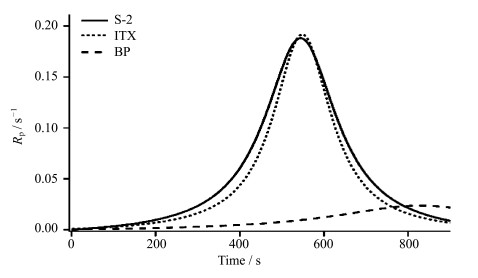 | 图 4 相同质量浓度(0.02%)的不同光引发剂引发HEMA单体聚合的双键反应速率曲线 Double bond reaction rate curve for HEMA monomer polymerization initiated by different photoinitiators at the same concentration (0.02%) |
3 结论本文合成了一种适用于UV-LED光固化体系的新型光引发剂S-2,并对其结构和性能进行了表征和测试。结果表明,光引发剂S-2在365~405 nm范围内有优异的紫外吸收性能,能够与目前广泛应用的365~405 nm范围内的UV-LED光源的发射光谱很好地匹配,且其在365、375、385及395 nm处的摩尔消光系数是异丙基硫杂蒽酮(ITX)在对应波长下的5倍以上,远优于ITX。另外,其具有比ITX更好的热稳定性。当S-2作为光引发剂引发单体HEMA聚合时,在质量浓度很低的情况下(0.02%)就可以使单体聚合的双键转化率达到70%以上,与ITX相当,同时S-2引发单体聚合的反应速率与ITX相似。对这类光引发剂进行进一步的结构设计和研究,会促进与LED匹配的光引发剂体系的进展。
致谢 感谢湖北固润科技股份有限公司给予科研经费支持。
参考文献
| [1] | 田东文, 吕昱. UV-LED低温固化技术特点及应用[J]. 广东印刷, 2014(5): 37-38. Tian D W, Lyu Y. UV-LED curing technology characteristics and application in low temperature[J]. Guangdong Printing, 2014(5): 37-38. DOI:10.3969/j.issn.1005-7463.2014.05.034 |
| [2] | Zhang J, Zivic N, Dumur F, Xiao P, Graff B, Fouassier J P, Gigmes D, Lalevee J. UV-violet-blue LED induced polymerizations: specific photoinitiating systems at 365, 385, 395 and 405 nm[J]. Polymer, 2014, 55(26): 6641-6648. DOI:10.1016/j.polymer.2014.11.002 |
| [3] | Zhang J, Campolo D, Dumur F, Xiao P, Gigmes D, Fouassier J P, Lalevee, J. The carbazole-bound ferrocenium salt as a specific cationic photoinitiator upon vear-UV and visible LEDs (365-405 nm)[J]. Polymer Bulletin, 2016, 73(2): 493-507. DOI:10.1007/s00289-015-1506-1 |
| [4] | 简凯, 李东兵, 胡春青, 杨金梁, 聂俊. 适用于LED光固化体系的光引发剂的研究进展[J]. 涂料工业, 2016, 46(10): 75-82, 87. Jian K, Li D B, Hu C Q, Yang J L, Nie J. Research progress of photoinitiators for LED photocuring systems[J]. Coating industry, 2016, 46(10): 75-82, 87. |
| [5] | 庞玉莲, 邹应全.含N, P, S, Si, F等杂原子的光引发剂的研究现状及进展[C].第十七届中国辐射固化年会暨首届安庆市化工新材料产业高峰论坛论文报告集. 2016: 21. Pang Y L, Zou Y Q. Research status and advances of photoinitiators containing N, P, S, Si, F atoms[C]. The 17th China Radiation Curing Annual Meeting and the First of Anqing City New Chemical Materials Industry Forum Proceedings. 2016: 21 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-GGXH201609001037.htm |
| [6] | Turbiez M, Frere P, Allain M, Videlot C, Ackermann J, Roncali J. Design of organic semiconductors: tuning the electronic properties of л-conjugated oligothiophenes with the 3, 4-ethylenedioxy-thiophene (EDOT) building block[J]. Chemistry-A European Journal, 2005, 11: 3742-3752. DOI:10.1002/chem.200401058 |
| [7] | Tursun A, Ruxangul J, Chunbao Z, Tunsagul A, Ismayil N. Structure and properties of solid-state synthesized poly (3', 4'-ethylenedioxy-2, 2':5', 2″-terthiophene)[J]. Synthetic Metals, 2010, 160: 325-332. DOI:10.1016/j.synthmet.2009.10.033 |
| [8] | Heinze J, Frontana-Uribe, Bernardo A, Ludwigs S. Electrochemistry of conducting polymers-persistent models and new concepts[J]. Chemical Reviews, 2010, 110(8): 4724-4771. DOI:10.1021/cr900226k |
| [9] | Jaafari A, Ouzeau V, Ely M, Rodriguez F, Chane-Ching K, Yassar A, Aaron J J. Synthesis and optical properties of novel 1, 3-propanedione bearing oligothiophene substituents[J]. Synthetic Metals, 2004, 147: 183-189. DOI:10.1016/j.synthmet.2004.10.002 |
| [10] | Zhu Y B, Wolf M O. Charge transfer and delocalization in conjugated (ferrocenylethynyl) oligothiophene complexes[J]. Journal of the American Chemical Society, 2000, 122(41): 10121-10125. DOI:10.1021/ja0008564 |
| [11] | Xiao P, Dumur F, Thirion D, Fagour S, Vacher A, Sallenave X, Morlet-Savary F, Graff B, Fouassier J P, Gigmes D, Lalevee J. Multicolor photoinitiators for radical and cationic polymerization : monofunctional vs polyfunctional thiophene derivatives[J]. Macromolecules, 2013, 46: 6786-6793. DOI:10.1021/ma401389t |
| [12] | Ji L, Edkins R M, Sewell L J, Beeby A, Batsanov A S, Fucke K, Drafz M, Howard J A K, Moutounet O, Ibersiene F, Boucekkine A, Furet E, Liu Z Q, Halet J F, Katan C, Marder T B. Experimental and theoretical studies of quadrupolar oligothiophene-cored chromophores containing dimesitylboryl moieties as P-accepting end-groups: syntheses, structures, fluorescence, and one- and two-photon absorption[J]. Chemistry-A European Journal, 2014, 20: 13618-13635. DOI:10.1002/chem.201402273 |
| [13] | 李会玲, 杨万泰. ITX/ EDAB光引发丙烯酸溶液聚合动力学[J]. 北京化工大学学报, 2001, 28(1): 45-47. Lin H L, Yang W T. Kinetic study on the photoinitiated polymerization of acrylic acid initiated using isopropylthioxanthone/ ethy-4(dimethylamino) benzoate pair[J]. Journal of Beijing University of Chemical Technology, 2001, 28(1): 45-47. |
