
 , 张金龙2
, 张金龙2

1. 核工业理化工程研究院, 天津 300180;
2. 华东理工大学 化学与分子工程学院 先进材料与制备教育部重点实验室, 上海 200237
2018-04-20 收稿, 2018-05-16 录用
国家自然科学基金项目(21573069)和国防科工业局军品配套项目(JPPT-125-4-076)
*通讯作者: 田宝柱, E-mail: baozhutian@ecust.edu.cn; 张金龙, E-mail: jlzhang@ecust.edu.cn
摘要: 本文利用光致诱导电子转移(PET)类探针的设计策略,合成了一种以吡喃腈类衍生物为母体、哌嗪为探测基团的新型pH荧光探针DCM-PA。结果表明:DCM-PA的最大吸收波长(λabs)和最大荧光发射波长(λem)分别为421 nm和590 nm,斯托克斯位移近170 nm。在pH=2~12范围内,DCM-PA的荧光强度随pH的升高而降低,pH=2时的荧光强度是pH=12时荧光强度的12倍;DCM=PA的pKa值为7.2,在pH=6~9范围,荧光强度与pH呈良好的线性关系。对比试验证实DCM-PA实现了pH检测的机理:酸性条件下,哌嗪基团与质子结合削弱了其供电子能力,使DCM-PA荧光增强;碱性条件下,哌嗪通过PET作用使探针荧光猝灭。抗干扰试验表明,DCM-PA在中性酸碱度下对多种阴、阳离子均具有良好的抗干扰能力。
关键词: 荧光探针pH吡喃腈光致诱导电子转移
Synthesis and Properties of a pH Fluorescent Probe Based on PET Mechanism
CHANG Shunzhou1, XIANG Kaiqiang2, MING Wei2, ZHANG Zhizhong1, TIAN Baozhu2

 , ZHANG Jinlong2
, ZHANG Jinlong2

1. Research Institute of Physical and Chemical Engineering of Nuclear Industry, Tianjin 300180, P. R. China;
2. Key Laboratory for Advanced Materials, School of Chemistry & Molecular Engineering, East China University of Science and Technology, Shanghai 200237, P. R. China
*Corresponding author: TIAN Baozhu, E-mail: baozhutian@ecust.edu.cn; ZHANG Jinlong, E-mail: jlzhang@ecust.edu.cn
Abstract: A novel pH fluorescent probe (DCM-PA) was synthesized by employing dicyanomethylene-4H-pyran derivative as the fluorophore and piperazine as the response unit. The maximum absorption wavelength(λabs) and maximum emission wavelength(λem) were tested to be 421 nm and 590 nm, respectively. This means that the stokes shift is near to 170 nm. It was found that the fluorescence intensity gradually increased with the increase of pH value in the pH range of 2-12. The pKa of DCM-PA was determined to be 7.2. In the range of pH=6-9, there exists a good linear relationship between the fluorescence intensity and pH value. The response mechanism of the pH probe was revealed by the control experiment:Under acidic conditions, the electron donating ability of piperazine group will weaken after combining with proton, leading to the enhancement of the fluorescence intensity. Under alkaline conditions, the fluorescence will be quenched by the photoinduced electron transfer (PET) process. Moreover, it was found that DCM-PA exhibited a good anti-interference ability to different cations and anions.
Key words: fluorescent probepHdicyanomethylene-4H-pyranphotoinduced electron transfer
生物体细胞内pH是影响其生命过程的一个重要参数,与细胞的增值和凋亡、离子传输、细胞内稳态、酶活动、药物抗体以及细胞内吞作用等密切相关[1]。最新医学研究表明,适宜的pH同样是保持人体正常生理活动的一个最关键参数[2, 3]。破坏或轻微改变健康细胞质和细胞器内的pH平衡会对生物体造成巨大的危害,甚至直接导致癌症、心肺疾病或神经等问题[4, 5]。一般情况下,正常组织内细胞内的pH维持在7.2~7.4。相比于正常细胞,癌细胞中的pH会发生明显的增大或减小[6-8],这种pH的差异可以作为肿瘤细胞的标识指标,从而提供一种识别癌症的新途径[9, 10]。因此,设计一种稳定可靠的方法对中性附近的pH变化进行定量和成像分析具有重要的意义[11-13]。
近年来,荧光探针因简单便捷,并可以在生物体内成像而受到研究者的广泛关注[14]。pH荧光探针通常有3种设计策略:(1)基于含氮杂环和氨基的酸碱反应[15-17];(2)基于酚羟基的酸碱反应[18, 19];(3)基于罗丹明开环闭环的原理[20, 21]。研究者发现:以含氮杂环为识别基团的pH探针更容易受到酸性的影响;以酚羟基为识别位点的pH探针更容易受到碱性的影响;以罗丹明开环闭环为机理的pH探针稳定性不高,存在金属离子也能引起探针开环的情况。因此,非常有必要设计合成出中性pH响应、选择性和稳定性更高的pH荧光探针。
本文利用光致诱导电子转移(PET)类探针的设计原理,合成了一种以吡喃腈类衍生物为母体、哌嗪基团为响应基团的pH荧光探针DCM-PA,通过滴定实验检测了其在pH=2~12范围内对H+的响应,并探索了该探针对多种阴、阳离子的抗干扰能力。此外,本文还通过对比试验,探索了该探针的pH响应机理。
1 实验部分1.1 试剂与仪器所用原料和溶剂均为分析纯。盐酸、哌啶和甲苯由上海凌峰化学试剂有限公司生产;脱氢乙酸、4-二甲氨基苯甲醛、4-哌嗪苯甲醛等, 购于萨恩化学技术(上海)有限公司。所有柱色谱所用硅胶粒径为200~300目,购自青岛海洋化工有限公司。
核磁共振氢和13碳谱在Bruker Avance-400Hz核磁共振仪上测定;紫外-可见吸收光谱使用SHIMADZU UV-Vis 2450分光光度计测试;荧光发射光谱用SHIMADZU RF-5301PC荧光光谱仪测试;质谱采用Waters LCT Premier XE电喷雾质谱仪测试。
1.2 探针DCM-PA和对比化合物DCM的合成1.2.1 DCM-PA的合成2, 6-二甲基-4H-4-亚吡喃基丙二腈根据参考文献[22]合成。
目标探针DCM-PA的合成步骤如下:在50 mL的茄型烧瓶中,加入2, 6-二甲基-4H-4-亚吡喃基丙二腈(275 mg, 1.6 mmol)、4-哌嗪苯甲醛(323 mg, 1.7 mmol)、20 mL甲苯,搅拌溶解。然后,加入0.3 mL哌啶和0.3 mL乙酸作为催化剂,回流反应8 h。反应结束后,冷却至室温,减压除去甲苯,将得到的红色油状固体溶于二氯甲烷(30 mL),再通过水洗和分液处理,有机相用无水硫酸钠干燥。减压干燥除去溶剂,得到棕红色固体物质,柱层析提纯(二氯甲烷/甲醇=30/1),得到150 mg目标产物DCM-PA,产率30%。
1HNMR (400 MHz, DMSO-d6):7.54(d, J=8 Hz, 2H), 7.42(d, J=16 Hz, 1H), 7.07(d, J=16 Hz, 2H), 6.95(d, J=8 Hz, 2 H), 6.78 (d, J=2 Hz, 1 H), 6.64(s, 1 H), 3.21(m, 4H), 2.83 (m, 4H);13CNMR (100 MHz, DMSO-d6):163.79, 160.76, 156.62, 152.48, 137.99, 129.57, 124.29, 115.70, 114.25, 105.49, 54.49, 45.17, 19.35. ESI-MS: calcd. for [C21H20N4O + H]+ 345.17; found 345.16;Element analysis: C 73.13; H 5.81; O 4.95; N 16.10。
1.2.2 DCM的合成用对二甲氨基苯甲醛替代4-哌嗪苯甲醛,采用与合成探针DCM-PA相似的方法合成对比化合物DCM。最终得到260 mg红色固体DCM,产率50%。
1HNMR (400 MHz, DMSO-d6):7.54(d, J=8 Hz, 2H), 7.41(d, J=16 Hz, 1 H), 7.00(d, J=16 Hz, 1H), 6.73(s, 3 H), 6.60(s, 1H), 2.55(s, 2H), 3.00(s, 6H), 2.40(s, 3H);13CNMR(100 MHz, DMSO-d6):163.66, 161.05, 151.58, 138.53, 129.77, 122.14, 112.80, 111.88, 105.42, 104.99, 54.02, 19.33;Element analysis: C 75.03; H 5.95; O 5.88; N 13.12。
 |
干扰离子(F-、Cl-、Br-、I-、ClO4-、CO32-、HCO3-、NO3-、Na+、K+、Zn2+、Al3+、Fe3+、Cu2+、Mn2+、Ni2+、Cr3+、Ag+、Pb2+、Ba2+)溶液由相应的盐配制,避光低温保存,测试前加入待测液。
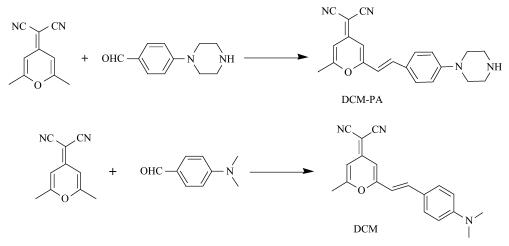
2 结果与讨论2.1 DCM-PA在酸性和碱性环境的吸收和荧光光谱图 1为DCM-PA在pH=2和pH=12下的紫外-可见吸收光谱和荧光发射光谱。如图所示,在pH=2时,DCM-PA在421 nm处呈现一个较宽的紫外吸收峰,590 nm处有一个较强的荧光发射峰;在pH=12时,421 nm处的吸收峰强度有所降低,而在590 nm处的荧光发射峰显著减弱,这可能是由于碱性条件下哌嗪对探针具有光致诱导电子转移(PET)的作用,使分子内电荷转移(ICT)受到抑制,发生荧光猝灭。值得一提的是,从pH=12到pH=2,590 nm处的荧光信号增强近9倍,这表明探针DCM-PA具有较高的pH响应灵敏度。根据DCM-PA的紫外-可见吸收峰和荧光发射峰,可知DCM-PA的斯托克斯位移(最大荧光发射波长λem与最大吸收波长λabs的差值)将近170 nm。探针具有大的斯托克斯位移有利于减少在检测过程中激发光和发射光的相互干扰,提高探针的检测灵敏度。
图 1
Fig. 1
 | 图 1 DCM-PA (10 μmol/L)在pH=2和pH=12下的紫外吸收光谱(a)和荧光发射光谱(b)激发波长为421 nm; 狭缝宽度为3/3 nm; 探针溶液测试环境为DMSO-PBS缓冲液(V/V=1/1, 0.02 mol/L)Fig.1 Absorption (a) and fluorescence (b) spectra of DCM-PA (10 μmol/L) at pH=2 and pH=12 λex=421 nm; slit width = 3/3 nm; all samples were recorded in DMSO-PBS buffer solution (V/V=1/1, 0.02 mol/L) |
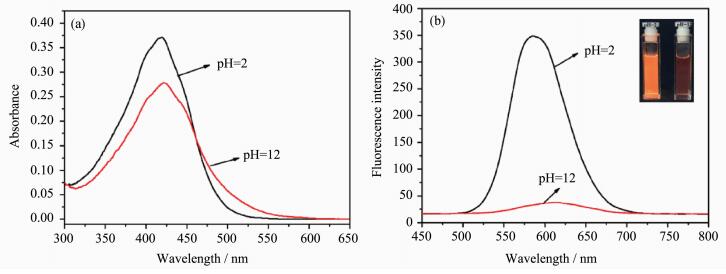
2.2 DCM-PA在不同pH下的荧光特性继续通过滴定实验详细测试DCM-PA在不同pH(2~12)下的荧光发射光谱(图 2),如图 2(a)和2(b)所示:在pH=2时,DCM-PA在590 nm处的荧光发射峰最强,随着pH的增大,该荧光发射峰强度逐渐降低,在pH=12时,590 nm处的荧光发射峰显著减弱。
图 2
Fig. 2
 | 图 2 (a) DCM-PA (10 μmol/L)在不同pH下的荧光光谱图;(b) 590 nm处荧光强度随pH变化图(c) DCM-PA在pH=6~9与荧光强度的关系;(d) pH与log[(Imax-I)(I-Imin)]关系图激发波长为421 nm; 狭缝宽度为3/3 nm; 探针溶液测试环境为DMSO-PBS缓冲液(V/V=1/1, 0.02 mol/L)Fig.2 (a) The fluorescent spetra of DCM-PA (10 μmol/L) under various pH; (b) fluorescent intensity at 590 nm vs different pH; (c) relationship between the fluorescence intensity of DCM-PA and pH 6~9; (d) plot of pH vs log[(Imax-I)(I-Imin)] λex=421 nm; slit width = 3/3 nm; all samples were recorded in DMSO-PBS buffer solution (V/V=1/1, 0.02 mol/L) |
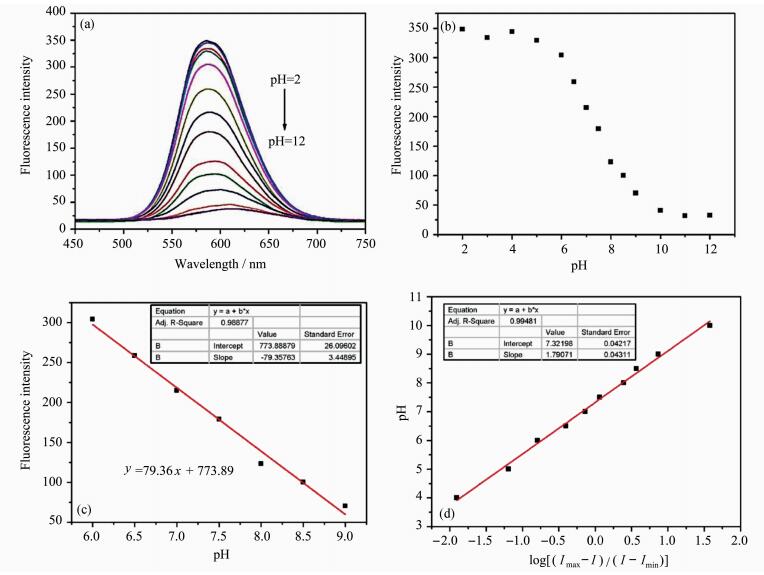
以不同pH为横坐标、以590 nm处荧光发射峰强度为纵坐标作图, 如图 2(c)所示,由图可知:在pH=6~9范围内,pH与荧光强度具有很好的线性关系,关联系数达到0.989。DCM-PA的pKa值通过Henderson-Hasselbalch方程(式1)确定[23]。
 | (1) |
2.3 DCM-PA的抗干扰性与可重复性多氮化合物可能与金属离子形成配位体而影响探针的荧光性能,因此,我们进一步考查了DCM-PA对23种阴、阳离子的抗干扰性。如图 3(a)和3(b)所示,在pH = 4和pH = 8时,干扰离子F-、Cl-、Br-、I-、ClO4-、CO32-、HCO3-、NO3-、SO42-、Na+、Ca2+、Mg2+、K+、Zn2+、Al3+、Fe3+、Cu2+、Mn2+、Ni2+、Cr3+、Ag+、Pb2+、Ba2+对DCM-PA的荧光发射光谱几乎没有影响,表明DC-PA具有良好的抗干扰能力。
图 3
Fig. 3
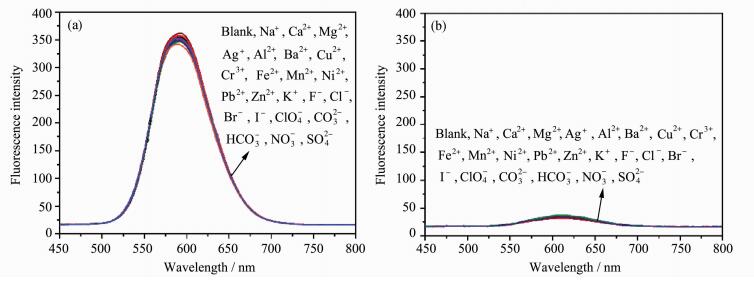 | 图 3 DCM-PA在pH=4(a)和pH=8(b)时,在23种干扰离子存在下的荧光光谱干扰离子的测试浓度均为200 μmol/L;激发波长为421 nm; 狭缝宽度为3/3 nm; 探针溶液测试环境为DMSO-PBS缓冲液(V/V=1/1, 0.02 mol/L)Fig.3 Fluorescent spectra of DCM-PA upon addition of 23 kinds of disturbing ions (200 μmol/L) at pH=4 (a) and pH= 8 (b) λex=421 nm; slit width = 3/3 nm; all samples were recorded in DMSO-PBS buffer solution (V/V=1/1, 0.02 mol/L) |
考虑到可重复性是衡量pH探针性能的重要指标,多次重复测试可以减小误差、节约成本[25, 26],因此我们研究了DCM-PA的可重复性。结果表明,在pH=4和pH=10时,DCM-PA重复使用5次后DCM-PA的荧光强度仍可以达到第一次使用时的95%,表明探针DCM-PA具有良好的可重复性(图 4)。
图 4
Fig. 4
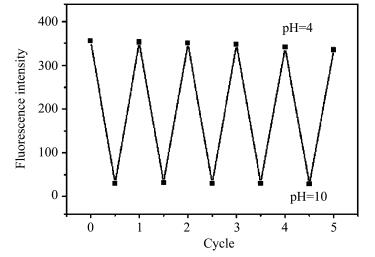 | 图 4 DCM-PA在pH=4和pH=10之间的5次循环实验激发波长为421 nm; 狭缝宽度为3/3 nm; 探针溶液测试环境为DMSO-PBS缓冲液(V/V=1/1, 0.02 mol/L)Fig.4 The reversibility of DCM-PA between pH=4 and pH=10 in PBS buffer solution λex=421 nm; slit width = 3/3 nm; all samples were recorded in DMSO-PBS buffer solution (V/V=1/1, 0.02 mol/L) |
2.4 DCM-PA的pH响应机理碱性条件下,哌嗪对染料母体的PET作用引起荧光猝灭,而酸性条件下哌嗪被质子化,打断其PET作用,从而实现对pH的高效响应(图 5)[24]。为了验证以上机理的可靠性,我们对比了加入三氟乙酸前后DCM-PA核磁氢谱的变化。如图 6所示,DCM-PA中加入三氟乙酸后,几乎所有核磁峰的位移均出现了向低场移动的趋势,特别是哌嗪上两组氢表现出明显的位移,这表明氢离子与哌嗪的结合削弱了N的电负性,使相邻氢的位移向低场区移动。
图 5
Fig. 5
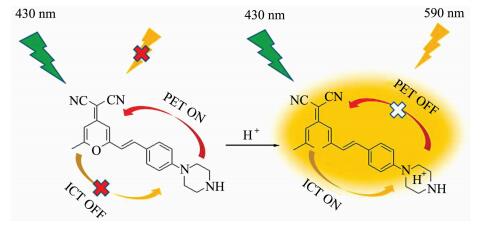 | 图 5 DCM-PA响应原理Fig.5 esponse mechanism of DCM-PA |
图 6
Fig. 6
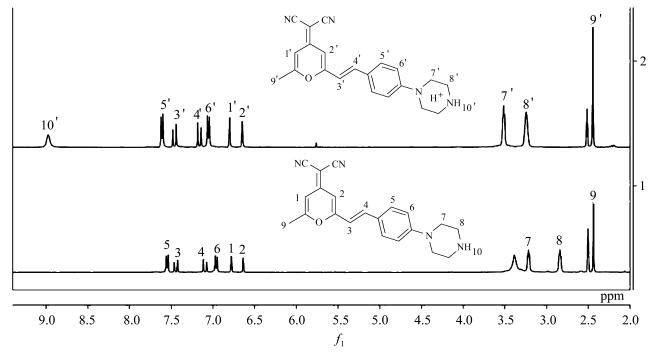 | 图 6 DCM-PA加入三氟乙酸前后核磁氢谱对比Fig.6 The comparision of 1HNMR spetra of DCM-PA before and after CF3COOH |
为了证明碱性条件下探针分子的荧光猝灭是由哌嗪基团的PET效应引起的,我们进一步测试了以4-二甲氨基为供电子基团的DCM在不同pH下的荧光光谱。如图 7所示,DCM在pH=2时荧光较弱,随着pH的增加,荧光逐渐增强,在pH=6~12范围内基本保持不变。通过以上对比实验可以看出:酸性条件下,相比于以哌嗪为供电子基团的DCM-PA,以二甲胺基为供电子基团的DCM母体并没有表现出荧光增强;碱性条件下,同样没有发生荧光猝灭。以上实验证明DCM-PA分子中哌嗪基团对探针具有PET作用,即:碱性条件下,PET作用使荧光猝灭,而酸性条件下哌嗪被质子化,打断其PET作用,哌嗪基团与质子结合削弱了其供电子能力,从而使DCM-PA荧光增强。
图 7
Fig. 7
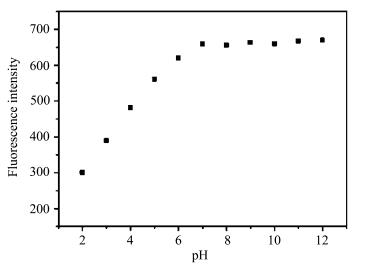 | 图 7 DCM (10 μmol/L)在不同pH下的荧光强度激发波长为425 nm; 狭缝宽度为3/3 nm; 样品测试环境为DMSO-PBS缓冲液(V/V=1/1, 0.02 mol/L)Fig.7 Fluorescent intensity of DCM (10 μmol/L) at different pH values λex=425 nm; slit width = 3/3 nm; all samples were recorded in DMSO-PBS buffer solution (V/V=1/1, 0.02 mol/L) |
3 结论本文合成了基于吡喃腈衍生物母体和哌嗪检测基团的荧光探针DCM-PA,其最大吸收波长(λabs)和最大荧光发射波长(λem)分别为421 nm和590 nm,斯托克斯位移(λem-λabs=169 nm)有利于减少检测过程中激发光和发射光的相互干扰,提高探针的检测灵敏度。
DCM-PA在pH = 2~12范围内具有良好的pH响应特性:荧光强度随pH的升高而降低,pH=2时的荧光强度是pH=12时荧光强度的12倍。DCM-PA的pKa值为7.2,在pH=6~9范围,荧光强度与pH呈良好的线性关系。
对比试验证实,DCM-PA实现pH检测的机理如下:酸性条件下,哌嗪基团与质子结合削弱了其供电子能力,从而使DCM-PA荧光增强;碱性条件下,哌嗪通过PET作用使探针荧光猝灭。抗干扰试验表明,DCM-PA在中性酸碱度下对多种阴、阳离子均具有良好的抗干扰能力。
本文所设计的pH探针具有宽的pH探测范围,特别是在中性条件下荧光强度与pH具有良好的线性关系,在生物体和环境pH探测方面具有一定的潜在应用价值。
参考文献
| [1] | Wan Q Q, Chen S M, Shi W, Li L H, Ma H M. Lysosomal pH rise during heat shock monitored by a lysosome-targeting near-infrared ratiometric fluorescent probe[J]. Angewandte Chemie, 2014, 53: 10916–10920.DOI:10.1002/anie.201405742 |
| [2] | Li Y H, Wang Y J, Yang S, Zhao Y R, Yuan L, Zheng J, Yang R H. Hemicyanine-based high resolution ratiometric near-infrared fluorescent probe for monitoring pH changes in vivo[J]. Analytical Chemistry, 2015, 87: 2495–2503.DOI:10.1021/ac5045498 |
| [3] | Lv H S, Huang S Y, Zhao B X, Miao J Y. A new rhodamine B-based lysosomal pH fluorescent indicator[J]. Analytica Chimica Acta, 2013, 788: 177–182.DOI:10.1016/j.aca.2013.06.038 |
| [4] | Wu M Y, Li K, Liu Y H, Yu K K, Xie Y M, Zhou X D. Mitochondria-targeted ratiometric fluorescent probe for real time monitoring of pH in living cells[J]. Biomaterials, 2015, 53: 669–678.DOI:10.1016/j.biomaterials.2015.02.113 |
| [5] | Cao X J, Chen L N, Zhang X, Liu J T, Chen M Y, Wu Q R, Miao J Y, Zhao B X. A NBD-based simple but effective fluorescent pH probe for imaging of lysosomes in living cells[J]. Analytica Chimica Acta, 2016, 920: 86–93.DOI:10.1016/j.aca.2016.03.029 |
| [6] | Zhang W J, Fan L, Li Z B, Qu T, Zhai H J, Yang J, Dong C, Shuang S M. Thiazole-based ratiometric fluorescence pH probe with large Stokes shift for intracellular imaging[J]. Sensors and Actuators B:Chemical, 2016, 233: 566–573.DOI:10.1016/j.snb.2016.04.122 |
| [7] | Shi X L, Mao G J, Zhang X B, Liu H W, Gong Y J, Wu Y X, Zhou L Y, Zhang J, Tan W H. Rhodamine-based fluorescent probe for direct bio-imaging of lysosomal pH changes[J]. Talanta, 2014, 130: 356–362.DOI:10.1016/j.talanta.2014.07.030 |
| [8] | Ma W J, Yan L A, He X X, Qing T P, Lei Y L, Qiao Z Z, He D G, Huang K H, Wang K M. Hairpin-contained i-motif based fluorescent ratiometric probe for high-resolution and sensitive response of small pH variations[J]. Analytical Chemistry, 2018, 90: 1889–1896.DOI:10.1021/acs.analchem.7b03972 |
| [9] | Wang Q, Zhou L, Qiu L, Wu Y, Zhang X B. An efficient ratiometric fluorescent probe for tracking dynamic changes in lysosomal pH[J]. Analyst, 2015, 140: 5563–5569.DOI:10.1039/C5AN00683J |
| [10] | Ni Y, Wu J S. Far-red and near infrared BODIPY dyes:synthesis and applications for fluorescent pH probes and bio-imaging[J]. Organic & Biomolecular Chemistry, 2014, 12: 3774–3791. |
| [11] | Zhang Y Y, Li S L, Zhao Z W. Using nanoliposomes to construct a FRET-based ratiometric fluorescent probe for sensing intracellular pH values[J]. Analytical Chemistry, 2016, 88: 12380–12385.DOI:10.1021/acs.analchem.6b03632 |
| [12] | Niu W F, Fan L, Nan M, Li Z B, Lu D T, Wong M S, Shuang S M, Dong C. Ratiometric emission fluorescent pH probe for imaging of living cells in extreme acidity[J]. Analytical Chemistry, 2015, 87: 2788–2793.DOI:10.1021/ac504109h |
| [13] | Liu X J, Su Y A, Tian H H, Yang L, Zhang H Y, Song X Z, Foey J W. Ratiometric fluorescent probe for lysosomal pH measurement and imaging in living cells using single-wavelength excitation[J]. Analytical Chemistry, 2017, 89: 7038–7045.DOI:10.1021/acs.analchem.7b00754 |
| [14] | 朱东建, 江华. 基于花菁的硫醇近红外比率荧光探针[J]. 影像科学与光化学, 2014, 32(1): 106–112. Zhu D J, Jiang H. Cyanine-based near-infrared ratiometric fluorescent probe for thiols[J]. Imaging Science and Photochemistry, 2014, 32(1): 106–112. |
| [15] | Tang Y, Kong X, Liu Z R, Lin W. Lysosome-targeted turn-on fluorescent probe for endogenous formaldehyde in living cells[J]. Analytical Chemistry, 2016, 88: 9359–9363.DOI:10.1021/acs.analchem.6b02879 |
| [16] | Zhang X X, Wang Z, Yue X Y, Ma Y, Kiesewetter D O, Chen X Y. pH-sensitive fluorescent dyes:are they really pH-sensitive in cells?[J]. Molecular Pharmaceutics, 2013, 10: 1910–1917.DOI:10.1021/mp3006903 |
| [17] | Liu W, Sun R, Ge J F, Xu Y J, Xu Y, Lu J M, Itoh I, Ihara M. Reversible near-infrared pH probes based on benzo[J]. Analytical Chemistry, 2013, 85: 7419–7425.DOI:10.1021/ac4013539 |
| [18] | Cao L X, Li X Y, Wang S Q, Li S Y, Li Y, Yang G Q. A novel nanogel-based fluorescent probe for ratiometric detection of intracellular pH values[J]. Chemical Communications, 2014, 50: 8787–8790.DOI:10.1039/C4CC03716B |
| [19] | Myochin T, Kiyose K, Hanaoka K, Kojima H, Terai T, Nagano T. Rational design of ratiometric near-infrared fluorescent pH probes with various pKa values, based on aminocyanine[J]. Journal of the American Chemical Society, 2011, 133: 3401–3409.DOI:10.1021/ja1063058 |
| [20] | Cao L X, Zhao Z S, Zhang T, Guo X D, Wang S Q, Li S Y, Li Y, Yang G Q. In vivo observation of the pH alternation in mitochondria for various external stimuli[J]. Chemical Communications, 2015, 51: 17324–17327.DOI:10.1039/C5CC07118F |
| [21] | Sarkar A R, Heo C H, Xu L, Lee H W, Si H Y, Byun J W, Kim H M. A ratiometric two-photon probe for quantitative imaging of mitochondrial pH values[J]. Chemical Science, 2016, 7: 766–773.DOI:10.1039/C5SC03708E |
| [22] | Guo Z Q, Zhao P, Zhu W H, Huang X M, Xie Y S, Tian H. Intramolecular charge-transfer process based on dicyanomethylene-4H-pyran derivative:an integrated operation of half-subtractor and comparator[J]. The Journal of Physical Chemistry C, 2008, 112: 7047–7053. |
| [23] | Tang B, Yu F B, Li P, Tong L L, Duan X, Xie T, Wang X. A near-infrared neutral pH fluorescent probe for monitoring minor pH changes:imaging in living HepG2 and HL-7702 cells[J]. Journal of the American Chemical Society, 2009, 131: 3016.DOI:10.1021/ja809149g |
| [24] | Lee M H, Park N, Yi C, Han J H, Hong J H, Kim K P, Kang D H, Sessler J L, Kang C H, Kim J S. Mitochondria-immobilized pH-sensitive off-on fluorescent probe[J]. Journal of the American Chemical Society, 2014, 136: 14136–14142.DOI:10.1021/ja506301n |
| [25] | Shi X L, Mao G J, Zhang X B, Liu H W, Gong Y J, Wu Y X, Zhou L Y, Zhang J, Tan W H. Rhodamine-based fluorescent probe for direct bio-imaging of lysosomal pH changes[J]. Talanta, 2014, 130: 356–362.DOI:10.1016/j.talanta.2014.07.030 |
| [26] | Li G P, Zhu D L, Xue L, Jiang H. Quinoline-based fluorescent probe for ratiometric detection of lysosomal pH[J]. Organic Letters, 2013, 15: 5020–5023.DOI:10.1021/ol4023547 |
