0 引言
【研究意义】蜜蜂不仅可以给人们提供营养丰富的蜂产品,而且在生态环境保护和农作物授粉等方面都发挥了重要作用,世界上有2/3的农作物依赖蜜蜂授粉。蜜蜂是变温动物,其生命活动与外界环境温度密切相关。低温是制约蜂群发展的主要因素,蜜蜂可以通过生态适应和自身体内的生理生化调节来应对寒冷环境,这种蜜蜂抵抗寒冷环境的能力称为蜜蜂耐寒性。蜜蜂的耐寒性在品种间存在差异,研究不同品种蜜蜂的耐寒性差异对耐寒蜂种的选择培育、区域饲养品种的选择等均具有理论和实际意义。【前人研究进展】昆虫耐寒性研究表明,昆虫可以采取不同的策略来应对寒冷环境,其抗寒机制包括降低体内含水量[1]、积累脂肪和小分子耐寒物质、大分子抗冻蛋白(抗冻蛋白、热休克蛋白等)的表达。昆虫体内的化学物质可以相互作用形成耐寒系统,在低温环境中,昆虫可以通过生理生化反应启动自身耐寒系统。不同昆虫的耐寒系统也存在一定差异。梁中贵等[2]报道了越冬松阿扁叶蜂(Acantholyda posticalis)体内抗寒系统为小分子碳水化合物、丙氨酸、甘油、糖蛋白;韩瑞东等[3]报道了越冬赤松毛虫(Dendrolimus spectabilis)体内抗寒物质系统为小分子碳水化合物类、糖蛋白、氨基酸类;孙绪艮等[4]研究证明,越冬桑尺蠖(Phthonadria atrilineata)的抗寒物质系统为小分子糖、氨基酸、糖蛋白。除此之外,昆虫体内在越冬期会积累一些大分子抗冻蛋白(抗冻蛋白AFP、热激蛋白HSP、脂蛋白等)。HUANG等[5]分离了美洲斑潜蝇(Liriomyza sativa)ls-hsp19.5、ls-hsp20.8、ls-hsp21.7,发现它们均为其抗寒必需成员,但是响应低温胁迫的强度不同;GRAHAM[6]克隆了多种抗冻蛋白的氨基酸序列,并对不同来源的抗冻蛋白进行比较,分离纯化编码抗冻蛋白的cDNA;BEHROOZI等研究表明,在极地和温带地区一些昆虫在越冬期时积累低分子糖或多元醇[7-9]。但是当前有关蜜蜂耐寒性的研究较少,周冰峰等[10]报道,在气温低于14℃的花期,中华蜜蜂(Apis cerana cerana,简称中蜂)出勤数是意大利蜜蜂(Apis mellifera ligustica,简称意蜂)的3倍。工蜂采集飞行最适温度为18—30℃,气温低于9.5℃,意蜂停止巢外活动,低于6.5℃中蜂停止巢外活动;李志勇等[11]针对越冬期东方蜜蜂和西方蜜蜂的过冷却点(super-cooling point,SCP)进行测试并对其与越冬性能的关系进行分析,结果发现在越冬期,东方蜜蜂过冷却点明显低于西方蜜蜂。相比而言,东方蜜蜂对低温具有更强的适应性和应变能力,更易抗寒越冬;常志光等[12]对不同蜂种越冬后期血淋巴SOD活力与抗寒力进行相关研究,结果表明卡尼鄂拉蜂(A. m. carnica)与意蜂血淋巴总SOD活力差异显著,其活力与过冷却点具有显著相关性。【本研究切入点】中蜂和意蜂对寒冷的适应力存在差异,但关于如何客观评价两者耐寒性和自身耐寒系统的差异仍缺少深入的研究。【拟解决的关键问题】通过比较越冬期间中蜂和意蜂过冷却点、冰点(freezing point,FP)、耐寒物质含量、关键酶活性以及基因表达的不同,客观评价两者抗寒性差异,为系统建立蜜蜂抗冻耐寒能力的测定与分析体系提供参考。1 材料与方法
试验于2015—2016年在山东农业大学动物科技学院完成。1.1 试验材料
试验蜂群在11月前人工饲喂越冬饲料,稳定群势,在山东农业大学试验蜂场室外相同环境条件进行越冬。于2015年12月中旬选取室外越冬的中蜂和意蜂各5群,每群随机抽取蜜蜂分别测定两者的过冷却点、冰点、水分、脂肪、糖原、蛋白质、小分子糖的含量、海藻糖酶活性及相关基因表达的差异。糖原试剂盒(苏州科铭生物技术有限公司)、海藻糖酶试剂盒(苏州科铭生物技术有限公司)、考马斯亮蓝(A045-2)低温恒温槽(DCW-3506型,宁波市海曙天恒仪器厂)和数据采集器(TemP32型,中国农业科学院农业气象研究所)、UV-2450紫外分光光度计、高效液相色谱仪(沃特世公司)、7500 Real-Time PCR仪(ABI 7500,USA)。1.2 试验方法
1.2.1 过冷却点、冰点测定 参考秦玉川等[13]的方法:采用热电偶方法进行过冷却点测定,使用的仪器为低温恒温槽和数据采集器等组成的过冷却点测定系统。将温度探头置于蜜蜂腹部,并进行固定,温度探头与计算机系统相连置于低温恒温槽中,蜂体温度随着恒温箱温度以2℃·min-1持续下降,直至蜂体开始结冰,蜂体释放潜热,温度陡然上升,释放潜能的起始处记录的温度为过冷却点;蜂体温度继续回升,直到再次下降,此转折点记录的温度即冰点[14]。取中蜂和意蜂各30只(每群6只)分别进行测定。1.2.2 蜂体含水量测定 从每群中蜂和意蜂蜂群中各取10只,用电子天平(精度0.01 mg)称量鲜重(FW),然后将蜜蜂样本放入电热恒温鼓风干燥箱中65℃,48 h后测定干重(DW),计算蜂体的游离水含量=[(FW-DW)/FW]×100%。将测完游离水的蜂体继续放入105℃干燥箱中72 h,测定质量(BW),计算蜂体的结合水含量=[(DW-BW)/DW]×100%。
1.2.3 蜂体脂肪含量测定 将测完含水量的蜂体
采用氯仿甲醇法用2 mL氯仿-甲醇(2﹕1)溶液匀浆,转入离心管,匀浆器用1 mL氯仿-甲醇溶液洗2次,离心10 min(3 000 r/min)后倒入新离心管,重复上一步。加入1.2 mL 1.6% CaCL2,盖紧摇晃后静置1 h,并用0.5 mL 2% CaCL2-氯仿-甲醇(3﹕8﹕4)混合液的下层液清洗两次,转入离心管。离心10 min,将上层液用吸管吸去,并取1 mL 2% CaCL2-氯仿-甲醇(3﹕8﹕4)混合液的上层液轻轻置于离心管下层液。离心10 min,将上层液小心吸去,下层液转入称过的称量瓶中,在70℃干燥24 h,称重即为脂肪质量。
1.2.4 蜂体糖原含量测定 每群取10只蜜蜂,采用糖原含量试剂盒测定。将蜂体加入0.75 mL提取液充分匀浆,转移至10 mL试管中,然后置于沸水浴中煮沸20 min,隔5 min振摇试管一次,使充分混匀,待蜂体全部溶解后,取出试管冷却,用蒸馏水定容至5 mL,混匀,紫外分光光度计620 nm处测定吸光度。
1.2.5 小分子糖含量测定 每群取30只蜜蜂,用毛细管分别取意蜂和中蜂血淋巴各50 μL于离心管中,加入100 μL 10%三氯乙酸摇匀,3 000 r/min离心3 min后取上清过滤。过滤后的样品以标准甘露醇、山梨醇、海藻糖溶液作为对照,采用液相色谱分析仪进行测定。
1.2.6 蛋白质含量和海藻糖酶活测定 每群取15只蜜蜂,采用海藻糖酶试剂盒测定。按照蜂体组织质量(g)或血淋巴(mL)﹕提取液体积(mL)为1﹕9的比例,冰浴中匀浆。8 000×g,4℃离心10 min,取上清紫外分光光度计550 nm测定。余下蜂体上清可用提取液1﹕9稀释、血淋巴上清1﹕49稀释后,用考马斯亮蓝方法,在紫外分光光度计595 nm处测定蛋白浓度。
1.2.7 总RNA提取与实时荧光定量PCR(qRT-PCR) 采用qRT-PCR法检测海藻糖酶基因(Trehalase-1,Tre-1)、海藻糖酶(Trehalase-2,Tre-2)、海藻糖合成酶基因(Trehalose-6-phosphate Synthase,TPS)和葡萄糖焦磷酸化酶基因(UDP-Glucose Pyrophosphrylase,UGP)的表达水平。每群选取两只蜜蜂液氮研磨,Trizol法提取总mRNA,然后使用反转录试剂盒(TaKaRa:DRR037A)立即反转录为cDNA,调节样品cDNA浓度于相同水平后,-20℃保存备用。qRT-PCR取1 000 ng cDNA加入到20 μL荧光定量体系中,按照荧光定量试剂盒(TaKaRa)操作指南,用7500 Real-Time PCR仪(ABI 7500,USA)检测目的基因相对表达量。反应程序:预变性95℃,10 s;变性95℃,5 s;退火60℃ 40 s,40个循环,熔解曲线添加,1个循环。目的基因引物设计参考序列来自于NCBI 数据库,以action和β-actin为内参,采用Primer 5.0进行引物设计,委托生工生物科技有限公司合成引物,引物序列如表1所示。
Table 1
表1
表1基因引物序列
Table 1Sequences of gene primers
| 目的基因 Target gene | 引物序列 Primer sequence(5′-3′) | 登录号 GenBank number |
|---|---|---|
| 海藻糖酶 Trehalase-1 | F: CTTCCCAGACAGCAAGACG | XM_393963 |
| R: GTTTGTTCCCCGTTTCATTC | ||
| 海藻糖酶 Trehalase-2 | F: AGCCGTTGGTTCATACTGGA | XM_016917975 |
| R: CGTTTCCCATCCTTTGATTG | ||
| 海藻糖合成酶 Trehalose-6-phosphate Synthase | F: TGGCTTAGATTGGAGTGAACG | XM_003249185 |
| R: TGATGACGCTACACGGAAAG | ||
| 尿苷二磷酸葡萄糖焦磷酸化酶 UDP-Glucose Pyrophosphrylase | F: AACGCAGTCCCTCAGATACG | XM_624660 |
| R: ATCCCATTCCAACGAAGGTC | ||
| β-action (A. c. cerana) | F: GTTTTCCCATCTATCGTCGG | XM_017065464 |
| R: TTTTCTCCATATCATCCCAG | ||
| β-肌动蛋白 (A. m. ligustica) β-action | F: CCGTGATTTGACTGACTACCT | XM_001185145 |
| R: AGTTGCCATTTCCTGTTC |
新窗口打开
1.3 数据分析
数据采用SAS 9.2软件进行单因素方差分析(one-way ANOVA)和T检验进行比较分析,结果表示为平均值±标准差。P<0.05表示差异显著。2 结果
2.1 越冬期中蜂和意蜂过冷却点及冰点
越冬期中蜂和意蜂的过冷却点分别为(-7.58± 0.19)、(-6.88±0.15)℃,冰点分别为(-3.75±0.28)、(-3.50±0.32)℃。同一时期中蜂的过冷却点显著低于意蜂(P<0.05),但冰点无显著差异(P>0.05)。该结果表明在越冬期中蜂的耐寒能力要优于意蜂(图1)。 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1中蜂和意蜂过冷却点能力
-->Fig. 1The supercooling ability of A. c. cerana and A. m. ligustica
-->
2.2 越冬期中蜂和意蜂蜂体含水量
中蜂和意蜂体内结合水含量分别为(4.13±0.33)%和(1.45±0.05)%,两者差异显著(P<0.05)。而游离水含量结果与结合水含量相反,中蜂游离水含量(62.03±0.84)%显著低于意蜂蜂体游离水含量(71.24±0.29)%(P<0.05)(图2)。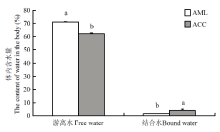 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2中蜂和意蜂蜂体含水量
-->Fig. 2The content of water in the body of A. c. cerana and A. m. ligustica
-->
2.3 越冬期中蜂和意蜂蜂体脂肪、糖原含量
越冬期中蜂和意蜂蜂体脂肪含量没有显著差异(P>0.05),分别为(5.98±1.35)%、(8.79±0.91)%。但是两者糖原含量差异显著,中蜂蜂体糖原含量(8.12±0.90)mg·g-1显著高于意蜂(5.24±0.29)mg·g-1(P<0.05)(表2)。Table 2
表2
表2中蜂和意蜂蜂体脂肪和糖原含量
Table 2Fat and glycogen content in the body of A. c. cerana and A. m. ligustica
| 组别 Group | 脂肪含量 Content of fat (%) | 糖原含量 Content of glycogen (mg·g-1) |
|---|---|---|
| 中蜂 A. c. cerana | 5.98±1.35a | 8.12±0.90a |
| 意蜂 A. m. ligustica | 8.79±0.91a | 5.24±0.29b |
新窗口打开
2.4 越冬期中蜂和意蜂蛋白质含量
中蜂蜂体和血淋巴蛋白质含量分别为(4.14±0.01)、(7.94±0.33)g·L-1;意蜂蜂体和血淋巴蛋白质含量分别为(3.65±0.02)、(7.42±0.01) g·L-1,中蜂虽比意蜂蛋白质含量高,但没有达到显著水平(P>0.05)(图3)。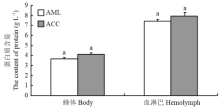 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3中蜂和意蜂蜂体和血淋巴蛋白质含量
-->Fig. 3The content of protein in the body and hemolymph of A. c. cerana and A. m. ligustica
-->
2.5 越冬期中蜂和意蜂血淋巴小分子糖含量
意蜂和中蜂血淋巴甘露醇分别为(3.99±0.09)、(6.72±0.50)mg·mL-1,差异显著(P<0.05);海藻糖浓度为(11.37±0.33)、(15.87±0.28)mg·mL-1,差异显著(P<0.05);山梨醇浓度分别为(4.82± 0.48)、(9.61±0.75) mg·mL-1,差异显著(P<0.05)。表明越冬期中蜂血淋巴小分子糖含量明显高于意蜂(图4)。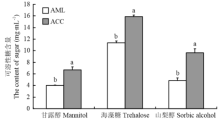 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4中蜂和意蜂蜂体和血淋巴可溶性糖含量
-->Fig. 4The content of sugar in the body and hemolymph of A. c. cerana and A. m. ligustica
-->
2.6 越冬期中蜂和意蜂海藻糖酶活性
意蜂蜂体海藻糖酶活(13.33±0.15)μg·min-1·mg-1显著高于中蜂(12.69±0.17)μg·min-1·mg-1(P<0.05);血淋巴海藻糖酶活性的结果与蜂体一致,中蜂与意蜂分别为(6.00±0.01)、(6.43±0.01)μg·min-1·mg-1,差异显著(P<0.05)(图5)。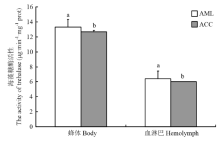 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图5中蜂和意蜂蜂体和血淋巴海藻糖酶活性
-->Fig. 5The activity of trehalase in the body and hemolymph of A. c. cerana and A. m. ligustica
-->
2.7 越冬期中蜂和意蜂Tre-1、Tre-2、UGP、TPS表达水平
采用qRT-PCR法对中蜂和意蜂海藻糖酶-1(Tre-1)、海藻糖酶-2(Tre-2)、葡萄糖焦磷酸化酶基因(UGP)和海藻糖合成酶基因(TPS)的表达水平进行了测定,结果表明意蜂的Tre-1表达量明显低于中蜂(P<0.05);意蜂Tre-2表达量比中蜂显著升高(P<0.05);在海藻糖合成途径中,越冬时TPS表达量在中蜂和意蜂之间没有显著差异(P>0.05);意蜂UGP表达量相比于中蜂显著提高(P<0.05)(图6)。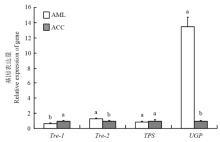 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图6中蜂和意蜂Tre-1、Tre-2、TPS、UGP表达水平
-->Fig. 6The expression level of Tre-1, Tre-2, TPS, UGP of A. c. cerana and A. m. ligustica
-->
3 讨论
蜜蜂耐寒性是其越冬性能的重要体现。昆虫体液可以耐受0℃以下的低温仍不结冰,这种现象称为过冷却[15]。在许多昆虫耐寒性的研究中,过冷却点常作为衡量耐寒性强弱的重要指标[16]。过冷却点是昆虫体内液体结冰的温度[17],研究表明甲虫的过冷却点呈现明显的季节性变化,越冬期间过冷却点显著降低,因此过冷却方式是其在低温下存活的重要策略[18]。本试验研究显示中蜂过冷却点显著低于意蜂,其结果与李志勇等[11]的测定结果一致,说明中蜂的耐寒能力显著高于意蜂,可以更好地适应中国北方地区的冬季低温胁迫而顺利越冬,对其群体的存活和繁殖均有重要意义。当寒冷冬季外界温度变化时,昆虫体内的水分状态与其抗冻能力有很大关系,有些昆虫在越冬前会降低体内含水量或提高结合水和游离水的比例来增强耐寒性[19-20]。梁中贵等研究显示松阿扁叶蜂和赤松毛虫幼虫在越冬前将体内游离水转化为结合水[2-3];于令媛等[21]研究表明,在2009年11月至次年3月(越冬期)大草蛉(Chrysopa pallens)预蛹体内含水量与7月份(生长期)相比显著降低,其中1月体内含水量最低,而7月升至最高。本研究中越冬期中蜂蜂体游离水含量明显低于意蜂,引起过冷却点和冰点降低,避免胞内和其他重要部位受冷害[22],与上述研究结果一致。
脂肪和糖原是昆虫越冬期间的主要能源物质,在冬季温度降低时虫体即开始储存糖原,以保证顺利度过越冬期[23]。本研究中中蜂和意蜂脂肪含量没有明显差异,这可能是由于蜜蜂个体较小所导致的。中蜂蜂体糖原含量在越冬期明显高于意蜂,并且差异显著,这与王鹏等[24]的研究结果相符。ROZSYPAL等[25]研究显示糖原在越冬期其含量逐渐下降,说明糖原也是衡量越冬昆虫抗寒能力的一个重要指标,中蜂机体可以在寒冷条件下转化生成更多的糖原为自身所需供能。
越冬期中蜂和意蜂蜂体和血淋巴蛋白质含量均没有明显差异,这可能是与试验昆虫种类有关,蛋白质并不一定是蜜蜂越冬供能的主要物质。越冬期间许多昆虫体内聚集低分子量的糖(醇)等小分子抗寒物质,如葡萄糖、山梨醇、甘露醇、海藻糖等以及氨基酸和脂肪酸等物质[26-27]。试验测定在越冬期中蜂血淋巴山梨醇、甘露醇以及海藻糖的含量明显高于意蜂,并且差异显著,这与陈永杰等[28]报道的桑螟(Diaphania pyloalis)越冬幼虫在越冬初期至越冬后期海藻糖、果糖、甘露醇、山梨醇的含量在血淋巴内含量显著上升的结果相符。说明中蜂相对于意蜂在越冬期体内积累更多小分子抗寒物质,便于顺利越冬。但是这些物质的变化是通过增加体内含水量,还是直接通过与酶或其他蛋白质共同作用起到耐寒的功能还有待于进一步研究。
作为昆虫体内重要的血糖,海藻糖存在于昆虫几乎所有的组织和器官中[29],而血淋巴海藻糖含量的变化对于昆虫调控碳水化合物的摄取以及体内营养的动态平衡具有重要作用[30]。由于海藻糖结构相当稳定,能在细胞表面形成特殊的保护膜,有效地保护生物分子结构,从而能够使生物体在寒冷、高温、干燥失水等恶劣条件下还能有效维持生命活动及生物特征。海藻糖酶是海藻糖代谢过程中一个重要的酶,特异性地将一分子海藻糖水解为两分子葡萄糖而被昆虫利用[31]。中蜂蜂体和血淋巴海藻糖酶活性均显著低于意蜂,表明在越冬期寒冷条件下,中蜂通过降低海藻糖酶活性积累更多的海藻糖,从而在寒冷冬季到来时释放更多葡萄糖。在昆虫海藻糖合成代谢过程中,研究比较深入的是6-磷酸海藻糖合成酶(TPS)合成途径。主要过程由海藻糖合成酶(TPS)催化尿苷二磷酸葡萄糖(UDP-G)和6-磷酸葡萄糖合成6-磷酸海藻糖,然后在6-磷酸海藻糖磷酸酯酶(TPP)催化下形成海藻糖,其中UDP-G由尿苷二磷酸葡萄糖焦磷酸化酶(UGP)催化而成[32]。分解途径是由海藻糖酶专一性分解为两分子的葡萄糖[27]。其中海藻糖酶有两种,一种为可溶型(Tre-1),另一种为膜结合型(Tre-2)。本研究显示在合成途径中中蜂TPS表达量高于意蜂,但是差异不显著;然而意蜂UGP表达量相比于中蜂显著提高,这可能是因为在越冬前期中蜂积累海藻糖含量已经足够抵御当时低温环境,相反意蜂还需要合成更多的海藻糖,导致UGP表达更加活跃。中蜂Tre-1表达量上调的结果与邬梦静等[33]试验结论一致:海藻糖酶基因在低温下上调,表明其能够通过控制昆虫海藻糖的含量来调控抗寒过程。有两种可能:一是在越冬期海藻糖酶活性升高,加速海藻糖分解为葡萄糖供能;二是由于TPS表达上调导致的。而中蜂Tre-2表达量略低,说明这两种酶在其中行使功能可能不同,这与秦资[34]关于异色瓢虫(Harmonia axvridis)海藻糖酶基因低温处理的变化结果相符。在越冬期间,Tre-1和Tre-2的表达与TPS表达相互调节,使昆虫体内海藻糖含量达到相对平衡。而Tre-1和Tre-2的表达差异可能与其催化效率不同有关。对于TPS、Tre-1、Tre-2三者之间的相互协调机制还需要进一步的深入研究。
4 结论
越冬期间中蜂的过冷却点显著低于意蜂,中蜂体内游离水含量降低、糖原等小分子糖含量的提高与抗寒性强弱密切相关,是越冬后期其群势和存活率高于意蜂的重要原因。Tre-1、Tre-2、TPS、UGP的表达证实海藻糖在蜜蜂越冬过程中具有重要作用。The authors have declared that no competing interests exist.
