0 引言
【研究意义】地膜作为重要的生产资料,对提高农民收益和保障粮食安全具有重要意义[1]。同时,地膜难以降解的特性及其在农田中的不合理利用,造成中国农田土壤中残膜的大量积累,新疆地区地膜残留强度最高可达502.2 kg·hm-2 [2]。随着土壤中地膜残留强度的增加,残膜带来的负面效应日益凸显,如土地质量恶化、作物产量下降、环境污染等[3-4]。因此,研究残膜对土壤质量的影响对于残膜防治工作具有重要的指导意义。【前人研究进展】残膜对土壤物理性质影响较大,造成土壤板结、孔隙度减小、水分移动受阻、通透性变差等一系列问题[5-6]。例如,残膜强度为200 kg·hm-2时,将明显影响土壤水分的上下移动,饱和导水率仅为无膜处理的12%[7];土壤中残膜强度为360 kg·hm-2时,土壤容重较对照增加5.8%—7.2%[8]。同时,残膜影响土壤化学性状,导致土壤肥力下降,董合干等[9]研究结果表明,随着地膜残留强度的升高,土壤有机质、碱解氮、有效磷和有效钾含量下降,残膜强度达到2 000 kg·hm-2时,其含量分别降低16.7%、55.0%、60.3%、17.9%。但也有试验表明,残膜强度为0—400 kg·hm-2时对土壤的化学性质影响不大[8]。造成试验结果存在差异的原因为试验周期短和残膜强度差异较大。【本研究切入点】近年来,中国农用地膜用量不断增加,农田土壤大量地膜残留造成的“白色污染”现象普遍,然而残膜对土壤化学性质的影响研究较少,且存在一定争议[9],尤其残膜强度对土壤微生物特征的影响研究鲜有报道。【拟解决的关键问题】本研究拟通过5年不同残膜强度梯度田间试验,分析残膜对农田土壤养分以及土壤微生物特征的影响,探讨残膜强度对土壤质量的影响机制,明确产生危害的土壤残膜强度限值,为中国残膜污染防治工作提供理论支撑。1 材料与方法
1.1 试验地概况
试验于2011—2015年在甘肃省农业科学院张掖节水农业试验站(39.4°N,99.0°E)进行。试验站位于甘肃省河西走廊中部,海拔1 570 m,年平均日照时数3 085 h,平均气温7℃,≥10℃积温2 896℃,无霜期153 d。该地区属于温带大陆性干旱气候,年降水量不足130 mm,平均年蒸发量2 075 mm,属于典型的“无灌溉就无农业”的干旱灌溉地区,具有西北绿洲灌溉农业区的典型特征。供试土壤类型为灌淤土,质地轻壤,试验前采集0—20 cm耕层土壤测定土壤现化性质:田间持水量为31.7%,土壤有机质含量7.9 g·kg-1,速效磷24.7 mg·kg-1,速效钾82.0 mg·kg-1。1.2 试验设计
2011年播种前,人工将地膜剪碎为边长5 cm和边长10 cm的正方形碎片,将两种大小的碎片以1﹕1的比例混合后,按地膜残留强度0(CK)、150 kg·hm-2(T1)、300 kg·hm-2(T2)、450 kg·hm-2(T3)和600 kg·hm-2(T4)5个水平,把剪碎的地膜铺在地表,播种前随整地作业混入耕层。每个处理设置3次重复,采用随机区组排列,每个小区面积为22 m2。种植作物类型为玉米,品种沈丹-16号,种植行距40 cm,株距20 cm,每公顷播种量为12.5万株左右。采用全膜平作栽培,地膜使用量为90 kg·hm-2,玉米收获后人工回收当年覆盖的大块残膜,部分小块地膜仍保留在土壤中,补充因耕作或大风带走的初始残膜量,以保证试验过程中残膜强度基本稳定。玉米全生育期灌溉4次,灌溉定额为5 250 m3·hm-2,分别于拔节期、大喇叭口期、吐丝期、灌浆中期进行灌溉,比例为20﹕30﹕30﹕20。氮肥(N)施用量为270 kg·hm-2,磷肥(P2O5)施用量为195 kg·hm-2,肥料品种分别为尿素(N 46%)、过磷酸钙(P2O5 16%)。磷肥全作底肥,氮肥40%作底肥,30%大喇叭口期追施(条施),30%吐丝期期追施(条施)。
1.3 测定指标及方法
2015年作物收获后(10月),采用多点取样法取各小区0—20 cm耕层土壤混合样,将土壤带回实验室,过2 mm筛,部分鲜土4℃冰箱保存,并于7 d内测定土壤含水量、铵态氮(NH4+-N)、硝态氮(NO3--N)、微生物量碳(MBC)、微生物量氮(MBN)、土壤微生物群落丰度以及土壤酶活性等指标,另一部分土样进行风干,测定有机质、全氮以及Olsen-P含量。土壤含水量、有机质、全氮、NH4+-N、NO3--N以及Olsen-P均采用常规的土壤农化分析方法[10]。MBC、MBN测定采用氯仿熏蒸-0.5 mol·L-1 K2SO4提取,Multi N/C 3100总有机碳/总氮分析仪测定[11]。土壤微生物群落丰度采用Biolog(ECO板)微平板法测定(Biolog自动微生物鉴定系统),具体试验步骤如下:称取相当于10 g风干土的新鲜土壤,盛于100 mL灭菌水的三角瓶中,250 r/min振荡10 min,然后用无菌水分步稀释至10-3,取上清液(125 μL)接种到测试板的每个孔中,25℃条件下培养,每间隔24 h用Biolog仪器在590 nm波长下测定其吸光值,试验持续8 d。计算各处理测试板孔中溶液吸光值平均变化率(average well color development,AWCD)和多样性指数(丰富度、Shannon指数、Simpson指数以及McIntosh指数),计算公式见表1[12-13]。采用荧光微孔板检测技术(Varioskan Flash 4.00.53)测定α-葡萄糖苷酶(AG)、β-葡萄糖苷酶(BG)、纤维素酶(CBH)、木聚糖酶(BXYL)以及几丁质酶(NAG)活性[14](表2),具体测定方法如下:称取1 g鲜土于250 mL三角瓶中,加100 mL灭菌水,250 r/min振荡30 min,取50 μL荧光底物和200 μL土壤悬液加入96孔黑板孔中,25℃条件下培养4 h后加入10 μL的1 mol·L-1NaOH终止反应,采用酶标仪(Varioskan Flash 4.00.53)测定[15]。
Table 1
表1
表1计算吸光值平均变化率和土壤微生物群落功能多样性指数公式
Table 1Formulas for average well color development and functional diversity calculations of soil microbial communities
| 名称 Name | 用途 Function | 公式 Formula | 备注 Remark |
|---|---|---|---|
| 吸光值平均变化率 Average well color development | 表征了微生物群落碳源利用率 Characterization of microbial community carbon source utilization | AWCD=(∑ni)/95 | ni是第i孔的相对吸光值(C-R)i,95为培养基孔数ni is the relative absorptive value[(C-R)i] of the ith well and 95 is the number of well |
| 丰富度 Richness | 被利用碳源总数 Total amount of carbon source used | — | 每板中ni大于0.25的孔数 The number of well in each plate with ni>0.25 |
| Shannon | 评估物种丰富度 Assessing species richness | H=-∑(Pi×ln Pi) | Pi为第i孔相对吸光值与整个平板相对吸光值总和的比率Pi is the ratio of ni and the sum of relative absorptive value in the whole plate |
| Simpson | 评估某些最常见种的优势度指标 Assessing dominance index of some common species | D=1-∑Pi2 | 同上(为避免出现负数,在计算该指数时将吸光值扩大1000倍)The same as above (The absorptive values are enlarged 1000 times in Simpson to avoid the negative values) |
| McIntosh | 评估物种均匀度 Assessing species evenness | U=[∑(ni2)](1/2) | 同上The same as above |
新窗口打开
Table 2
表2
表2土壤酶功能、底物以及底物浓度
Table 2Extracellular enzymes assayed in soil microcosmos, including their functions, corresponding substrates, and substrate concentrations
| 酶Enzyme | 简写 Abbreviation | 功能 Function | 底物 Substrate | 底物浓度Substrate concentration(µ mol·L-1) |
|---|---|---|---|---|
| α-葡萄糖苷酶 α-1,4-glucosidase | AG | 降解淀粉 Starch degradation | 4-MuB-α-D-glucoside | 200 |
| β-葡萄糖苷酶 β-1,4-glucosidase | BG | 降解纤维素 Cellulose degradation | 4-MuB-β-D-glucoside | 400 |
| 纤维素酶 Cellobiohydrolase | CBH | 降解纤维素 Cellulose degradation | 4-MuB-β-D-cellobioside | 200 |
| 木聚糖酶β-1,4-xylosidase | BXYL | 降解半纤维素 Hemicellulose degradation | 4-MuB-β-D-xycloside | 400 |
| 几丁质酶 β-1,4-N-acetyl-glucosaminidase | NAG | 降解几丁质 Chitin degradation | 4-MuB-β-N-acetyl-D- glucosaminidase | 400 |
新窗口打开
1.4 数据处理
采用OriginLab 8.5软件作图,所有数据采用SPSS 19.0进行单因素方差分析(one-way ANOVA),统计分析处理间土壤理化性质、微生物量碳氮、土壤微生物群落丰度以及土壤酶活性之间的差异,多重比较采用Duncan法(P=0.05),平均值在P<0.05水平下的任何差异具有统计学意义。2 结果
2.1 残膜对土壤理化性质的影响
5年的大田试验表明,残膜对土壤含水量的影响较大,随着残膜强度的增加,土壤含水量显著增加(P<0.05)(图1),其中T4处理的土壤含水量最高,为14.5%,比CK处理提高了29.5%,达到显著差异水平(P<0.05)。少量残膜存在对水分的增加影响不显著,T1处理比CK处理增加了1.2%,T2和T3处理的土壤含水量在12.0%—12.8%之间,略高于CK处理,但无显著性差异(P>0.05)。残膜强度显著影响土壤有机质和全氮含量(P<0.05)(图1)。土壤有机质水平和残膜强度呈线性负相关关系,随着残膜强度的增加,土壤有机质含量显著降低(P<0.05)。当土壤中残膜强度达到300 kg·hm-2时,土壤有机质含量与CK相比,降低了8.3%,达到显著水平(P<0.05)。残膜强度为600 kg·hm-2时,土壤有机质含量最低,仅为18.4 g·kg-1,比CK处理降低13.1%。土壤全氮也表现出随残膜强度增加而显著降低趋势(P<0.05),残膜强度为600 kg·hm-2时,土壤全氮含量为0.86 g·kg-1,显著低于其他处理(P<0.05),与CK相比,土壤全氮含量降低9.7%。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图1残膜强度对土壤含水量、有机质以及全氮含量的影响
-->Fig. 1Effects of residual plastic film on soil water content, organic matter and total nitrogen
-->
不同处理间土壤NH4+-N、NO3--N以及Olsen-P含量存在显著差异(P<0.05),但三者随残膜强度增加的变化规律不同(图2)。NH4+-N随着残膜强度的增加表现出先增加后降低的趋势。T3处理的NH4+-N含量达到最大,为1.02 mg·kg-1,比CK(0.80 mg·kg-1)提高27.4%,达到显著水平(P<0.05),随后,土壤NH4+-N含量降低,T4处理NH4+-N含量为0.82 mg·kg-1,显著低于T2和T3处理(P<0.05)。土壤NO3--N和Olsen-P含量随残膜强度变化趋势基本相同,都表现出随着土壤残膜强度增加而显著降低(P<0.05),T1处理的NO3--N和Olsen-P含量最大,分别为6.8 mg·kg-1和44.0 mg·kg-1,比CK处理提高3.0%和7.8%,其中Olsen-P达到显著水平(P<0.05)。T4处理的NO3--N和Olsen-P含量最低,仅为4.3 mg·kg-1和26.0 mg·kg-1,与CK处理相比,分别降低63.2%和36.3%。
2.2 残膜对土壤微生物量和群落丰度的影响
残膜强度对土壤微生物量碳(MBC)和土壤微生物量氮(MBN)含量的影响结果表明(图3),随着残膜强度增加,MBC和MBN含量均呈现先升高后降低的趋势。CK处理下,土壤MBC和MBN含量较低,分别为68.2 mg·kg-1和15.8 mg·kg-1。T1和T2处理的土壤MBC和MBN含量较高,其中T2处理的土壤MBC和MBN含量达到最大,分别为155.5 mg·kg-1和30.4 mg·kg-1,比CK处理增加128.0%和92.4%,存在显著性差异(P<0.05)。而T3和T4处理的MBC和MBN含量显著降低(P<0.05),其分布范围分别为15.4—37.9 mg·kg-1和13.0—17.4 mg·kg-1。平均颜色变化率(average well color development,AWCD)表征了微生物群落碳源利用率,是反映土壤微生物活性、微生物群落生理功能多样性的重要指标。连续8 d每间隔24 h测得AWCD值如图4所示,试验开始前2 d,各处理AWCD值较低,且无显著性差异(P>0.05),而在第2—6 d内AWCD快速增加,各处理间差异逐渐明显,培养后期(7—8 d),AWCD增速变慢,趋于稳定。不同处理间AWCD变化曲线不同,残膜强度为150 kg·hm-2时,相同培养时间下AWCD值最高,之后随着残膜强度的增加,AWCD显著降低(P<0.05)。例如,在培养时间为8 d时,各处理AWCD大小顺序为T1>CK>T2>T3>T4,其中T1处理的AWCD值最高,为0.94,显著高于其他处理(P<0.05),T4处理的AWCD值最低,仅为0.74,比最高处理(T1)减少21.3%。
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图2残膜量对土壤铵态氮、硝态氮以及有效磷含量的影响
-->Fig. 2The effect of residual plastic film on soil ammonium, nitrate nitrogen and available phosphorus
-->
 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图3残膜量对土壤微生物量碳和微生物量氮含量的影响
-->Fig. 3The effect of residual plastic film on soil microbial biomass carbon and microbial biomass nitrogen
-->
为进一步确定残膜强度对土壤微生物丰度的影响,本文计算了丰富度、Shannon指数、Simpson指数以及McIntosh指数。计算结果显示(表3),T1处理的丰富度和McIntosh指数最高,与CK相比,分别增加3.7%和10.4%,其中后者达到显著性差异水平(P<0.05)。T2处理的Shannon指数和Simpson指数最高,分别为3.224和0.961,略高于CK,但无显著性差异(P>0.05)。而高残膜量下(T3和T4)微生物丰富度、Shannon指数、Simpson指数以及McIntosh指数降低,与CK相比,分别减少5.6%—11.1%,0.6%—2.1%,0.2%—0.3%以及7.7%—11.9%,除T3处理Shannon指数和Simpson指数以及T4处理Simpson指数外,其余均达到显著性差异水平(P<0.05)。
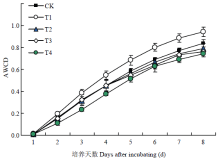 显示原图|下载原图ZIP|生成PPT
显示原图|下载原图ZIP|生成PPT图4平均颜色变化率(AWCD)随培养时间变化的曲线
-->Fig. 4AWCD changes with incubation progress
-->
Table 3
表3
表3农田残膜强度对土壤微生物AWCD和多样性指数的影响(培养8天)
Table 3The effects of residual plastic film on AWCD, richness, dominance and eveness indices of soil microbial communities (8 days after incubating)
| 处理 Treatment | AWCD | 丰富度 Richness | Shannon | Simpson | McIntosh |
|---|---|---|---|---|---|
| CK | 0.84±0.03(b) | 27.0±1.0(b) | 3.218±0.007(ab) | 0.957±0.004(ab) | 5.56±0.11(b) |
| T1 | 0.94±0.04(a) | 28.0±1.0(ab) | 3.190±0.002(c) | 0.958±0.004(ab) | 6.14±0.23(a) |
| T2 | 0.79±0.05(bc) | 26.3±0.6(bc) | 3.224±0.019(a) | 0.961±0.001(a) | 5.22±0.17(c) |
| T3 | 0.76±0.01(c) | 25.5±0.5(c) | 3.198±0.016(bc) | 0.954±0.001(b) | 5.13±0.03(cd) |
| T4 | 0.74±0.03(c) | 24.0±0.0(d) | 3.151±0.003(d) | 0.955±0.003(b) | 4.90±0.07(d) |
新窗口打开
2.3 残膜对土壤酶活性的影响
处理间不同种类酶活性均存在显著性差异(P<0.05)(表4),T2处理的木聚糖酶和几丁质酶活性较高,分别为847.4和1 317.8 nmol·g-1·h-1,是CK处理相应酶活性(182.5和439.3 nmol·g-1·h-1)的4.6倍和3.0倍。T3处理的α-葡萄糖苷酶、β-葡萄糖苷酶以及纤维素酶活性显著高于其他处理(P<0.05),分别为553.8、171.2和1 352.0 nmol·g-1·h-1,与其他处理相比,分别提高15.2%—175.1%、12.6%—74.3%以及70.8%—128.1%。总体而言,T2和T3处理5种酶活性普遍较高,而在低残膜水平和高残膜水平下,酶活性较低,该结果与MBC、MBN规律基本相同。Table 4
表4
表4不同残膜强度处理下的土壤酶活性
Table 4Soil enzyme activities in different amounts of residual plastic film treatment (nmol·g-1·h-1)
| 处理Treatment | α-葡萄糖苷酶α-1,4-glucosidase (AG) | β-葡萄糖苷酶β-1,4-glucosidase (BG) | 纤维素酶Cellobiohydrolase (CBH) | 木聚糖酶β-1,4-xylosidase (BXYL) | 几丁质酶β-1,4-N-acetyl-glucosaminidase (NAG) |
|---|---|---|---|---|---|
| CK | 201.3±14.1(d) | 126.3±5.0(c) | 716.2±82.4(bc) | 182.5±18.0(c) | 439.3±64.4(c) |
| T1 | 347.7±19.5(c) | 129.6±9.4(c) | 791.6±6.3(b) | 520.2±91.1(b) | 1116.9±169.5(ab) |
| T2 | 455.1±5.3(b) | 152.1±5.4(b) | 645.5±42.8(cd) | 847.4±96.8(a) | 1317.8±248.3(a) |
| T3 | 553.8±7.7(a) | 171.2±2.8(a) | 1352.0±55.4(a) | 563.4±46.1(b) | 1232.0±69.2(ab) |
| T4 | 480.6±26.3(b) | 98.2±7.3(d) | 592.7±13.5(d) | 661.3±134.7(b) | 957±75.4(b) |
新窗口打开
3 讨论
3.1 高残膜强度降低土壤养分含量
土壤中残膜的存在会阻碍表层土壤水分的下渗和上移,提高土壤含水量[8]。在甘肃干旱地区,年降雨量低于130 mm,远小于蒸发量,残膜的存在能够减少土壤表层水分蒸发,提高土壤含水量,有利于土壤保墒[16]。王志超等[7]通过室内模拟试验表明,残膜阻碍土壤过水能力,使得其土壤含水量明显高于无残膜处理。虽然残膜会提高土壤0—20 cm土层含水量,但由于其阻碍水分的下渗,导致土壤30—40 cm土壤含水量显著低于0—20 cm,影响作物根系的下扎,不利于其对土壤水分和养分的吸收[9]。连续5年的大田试验表明,土壤有机质含量和残膜强度呈显著负相关关系(P<0.05),残膜强度为600 kg·hm-2时,土壤有机质含量为18.4 g·kg-1,比空白处理低13.1%,该研究结果与董合干等[17]关于残膜强度500 kg·hm-2时,土壤有机质含量与空白处理相比,降低16.5%的研究结果相近。其主要原因为残膜影响玉米根系的生长,减少根系生物量,导致有机质输入量降低,有研究表明,当残膜强度达到720 kg·hm-2时,与无残膜处理相比玉米根系生物量降低12.5%[18]。同时,土壤有机质的腐质化过程需要微生物参与,高残膜强度土壤微生物量和酶活性较低,造成土壤有机质含量降低。土壤总氮随残膜强度的变化规律与有机质相似,主要因为土壤中氮素99%以上来自于有机质,有机质含量降低会导致土壤全氮含量相应的降低[19]。
不同处理间土壤NH4+-N、NO3--N和Olsen-P含量存在显著差异(P<0.05)。土壤NH4+-N含量表现出随着残膜强度增加先增加后降低的趋势,残膜强度为450 kg·hm-2的处理土壤NH4+-N含量最高,达到1.0 mg·kg-1,其原因可能为该残膜强度下土壤含水量增加导致土壤相关酶活性较高,从而有利于氨化作用的进行[20]。残膜强度为600 kg·hm-2时,土壤NH4+-N、NO3--N和Olsen-P含量均显著降低(P<0.05)。高残膜强度一方面会增加土壤容重,降低孔隙度,影响土壤的通气性[21],导致反硝化反应增强,N2O和N2的排放量增加;另一方面,由于土壤有机质含量降低,微生物可利用碳源减少,土壤微生物生长受到抑制,最终影响土壤有机氮的氨化速率和硝化速率[22-24]。
3.2 高残膜强度降低土壤微生物量、微生物群落丰度和酶活性
农田中残膜强度显著影响土壤微生物量碳、氮含量(P<0.05)。残膜强度≤300 kg·hm-2时,随残膜强度的增加,土壤微生物量碳、氮含量呈显著增加趋势。其原因主要为该阶段土壤含水量增加有利于提高土壤微生物活性[25-26],当农田中残膜强度大于450 kg·hm-2时,土壤微生物量碳、氮含量呈显著降低(P<0.05),高残膜强度下土壤有机质含量降低是造成土壤微生物量碳、氮含量较低的重要原因[27]。焦晓光等[28]对不同有机质含量土壤微生物量进行研究发现,有机质含量越高,土壤微生物量就越大。此外,残膜产生的邻苯二甲酸酯类有机污染物,具有致畸、致癌和致突变特点,高残膜强度下,土壤中有机污染物浓度较高,对土壤微生物产生毒害作用越大[29]。Biolog Eco板测定计算的平均颜色变化率、土壤微生物丰富度、Shannon指数、Simpson指数以及McIntosh指数分别表征微生物群落碳源利用率、碳源利用总数、物种丰富度、优势种的优势度以及物种均匀度,能够反映微生物群落代谢功能多样性[12-13]。低残膜强度下Eco板平均颜色变化率、土壤微生物丰富度、Shannon指数、Simpson指数以及McIntosh指数较高,说明其土壤微生物群落物种的数量、优势种的优势度以及各物种的均匀度等较高[30]。残膜强度超过450 kg·hm-2时,土壤微生物群落代谢多样性显著降低(P<0.05)。其原因与土壤微生量随残膜强度变化的原因相同。
土壤酶是土壤生态系统中最活跃的组分,在营养物质转化和有机质分解过程中起着非常重要的作用,其活性是评价土壤质量和生态健康的重要指标[32]。土壤α-葡萄糖苷酶、β-葡萄糖苷酶、纤维素酶、木聚糖酶以及几丁质酶主要参与有机质分解过程,受土壤水分、有机质、微生物活性等因素的影响[33],随着残膜强度的增加,以上5种酶活性先增加后降低,残膜强度为300—450 kg·hm-2时,酶活性普遍较高。当残膜强度超过450 kg·hm-2时,土壤酶活性有所降低。由此看出,土壤酶活性随残膜强度变化规律与土壤微生物量碳、氮以及土壤微生物群落丰度变化规律基本一致。主要因为土壤酶主要来源于土壤微生物的活动,土壤微生物量和微生物群落丰度均可影响土壤酶活性。李晨华等[34]研究表明,农田土壤真核微生物、细菌、古菌等丰度与大多数土壤酶活性呈显著正相关关系。
综上所述,农田土壤中低量残膜存在可适当提高土壤微生物量、微生物群落丰度和酶活性,但高残膜强度导致土壤土壤微生物量、微生物群落丰度和酶活性降低。
4 结论
低量残膜存在下可通过保水作用提高土壤微生物活性,而当残膜量超过450 kg·hm-2时,土壤微生物量、微生物群落丰度和土壤酶活性显著降低。同时,长期残膜作用下会降低土壤SOM、TN、NH4+-N、NO3--N以及Olsen-P含量,引起土壤养分退化。因此,对于中国地膜残膜污染较严重的地区,应加大残膜防治工作力度,降低残膜引起的土壤退化风险。The authors have declared that no competing interests exist.
