利用基因工程和蛋白表达技术,研究者们开发了具有自组装特性的人源重组重链铁蛋白(FTn),该铁蛋白自身具有靶向肿瘤的特性。然后,基于蛋白内部空腔结构及亲和金属特性,原位生长出各种不同类型的金属纳米颗粒,通过筛选,获得了高类过氧化物酶活性的纳米酶材料,能够产生高活性的自由基,诱导肿瘤细胞死亡信号。
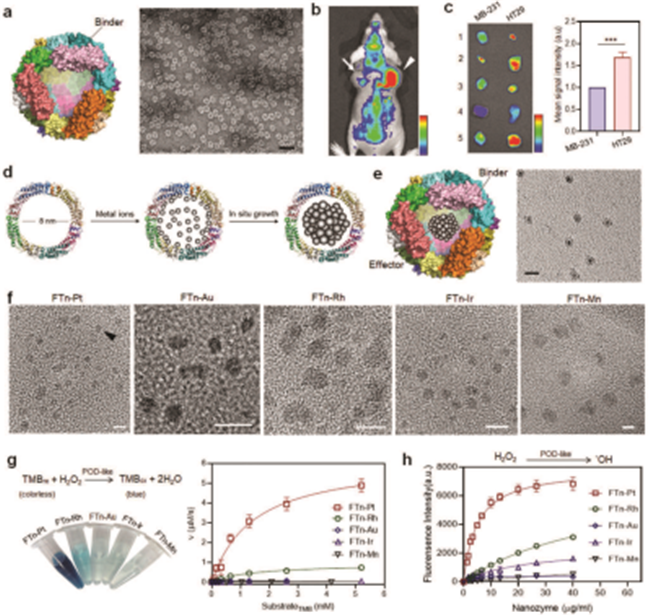 图1合成生物纳米酶的特性。a)FTn电镜图。b,c)FTn肿瘤靶向特性分析。d)金属颗粒在FTn腔内原位生成示意图。e)FTn纳米酶示意图及负染电镜图。f)基于FTn不同金属的纳米酶电镜图。g)不同金属纳米酶的类过氧化物酶活性分析。h)纳米酶催化产生羟基自由基的能力。
图1合成生物纳米酶的特性。a)FTn电镜图。b,c)FTn肿瘤靶向特性分析。d)金属颗粒在FTn腔内原位生成示意图。e)FTn纳米酶示意图及负染电镜图。f)基于FTn不同金属的纳米酶电镜图。g)不同金属纳米酶的类过氧化物酶活性分析。h)纳米酶催化产生羟基自由基的能力。对形貌和结合域的高度控制来定制所需纳米材料仍然是一个突出的挑战。本研究引入了一种基于重组人重链铁蛋白的模块化组装策略,用于精确和定量地定制高阶纳米结构。该策略将FTn作为蛋白构建块,在大肠杆菌中重组纯化后进一步通过两臂PEG进行再组装,使用这种蛋白质构建块的“自下而上”分层模块化组装策略,加上FTn内部的金属负载,产生了一系列新型多聚纳米酶。

图2a)通过两步自组装/后组装方法制备FTn多聚体的示意图。b-e)各种组装纳米结构的代表性TEM图像及量化分析。
组装的纳米多聚体具有可调节的蛋白质基数和多价结合结构域。这种多价组装有助于延长血液循环时间,并可以通过直接靶向细胞表面受体在肿瘤细胞内积累,并通过转胞吞机制深入渗透肿瘤组织。

图3FTn不同组装体的体内行为。a)静脉给药后不同组装体的血液循环时间曲线。不同组装体的b)肿瘤靶向能力分析,c)血管穿透能力分析,d-f)肿瘤组织渗透能力分析。
该研究基于合成生物学技术发展新型纳米技术,通过利用重组人重链铁蛋白组装的纳米多聚体作为支架,将金属纳米簇原位掺入蛋白质纳米笼的腔中,创造了一系列新型的人工纳米酶。同时,结合“自下而上”模块化组装策略,构建了多价纳米酶材料,来提高肿瘤靶向能力和治疗效果。此策略也为生物医学纳米材料的精准设计提供了思路。该研究获得国自然重大研究计划培育项目、面上项目,天津市合成生物专项、绿色项目等项目资助。
全文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202103128
