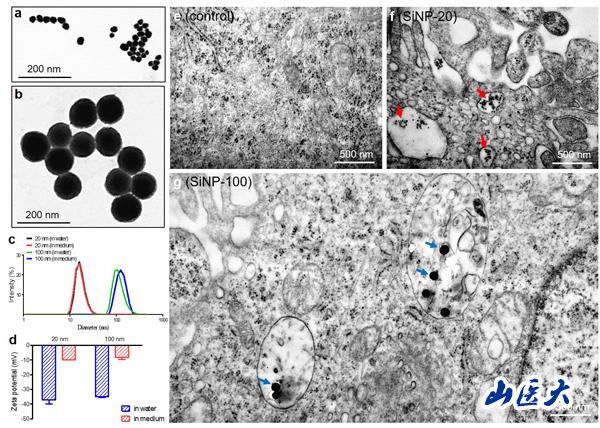
(电镜下二氧化硅纳米颗粒SiNPs形态及内吞作用)
该研究首次报道了二氧化硅纳米粒子(SiNPs)在分子、细胞和整体水平对内皮细胞的毒性作用及其损伤机制。该研究针对颗粒直径为20 nm和100 nm的SiNPs可能造成的不同毒性作用,在体外培养的人脐静脉内皮细胞(HUVECs)和成年雌性Balb/c小鼠中进行研究。
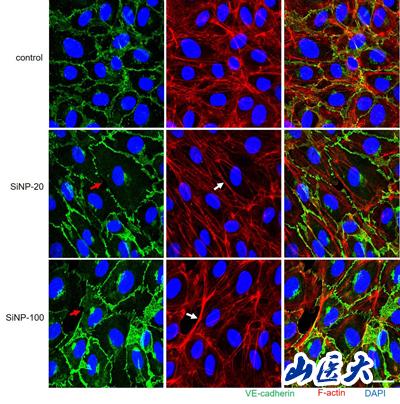
(SiNPs对HUVEC细胞连接完整性的影响)
在细胞实验中,发现SiNP-20和SiNP-100均使HUVECs细胞活力降低,细胞膜受损,并以浓度依赖性的方式抑制HUVECs的迁移和管的形成。两种SiNPs均可诱导显著的钙动员和活性氧(ROS)的产生,增加血管内皮(VE)-cadherin在酪氨酸731残基位点(pY731-VEC)的磷酸化,降低VE-cadherin的表达,破坏VE-cadherin的连续性并诱导F-actin在HUVECs中的重新组装。通过YM58483阻断Ca2+释放激活Ca2+(CRAC)通道或n -乙酰半胱氨酸(NAC)消除ROS,可逆转对内皮细胞的损伤。
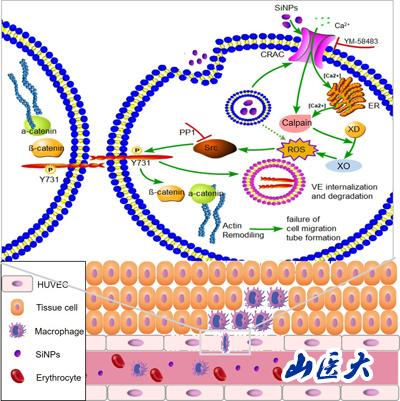
(本研究提出导致SiNPs诱导内皮屏障损伤的信号通路示意图)
在体实验中,静脉注射SiNP-20和SiNP-100均以剂量、颗粒大小和暴露时间依赖的方式诱导Balb/c小鼠多器官的损伤。在SiNPs暴露后,可引起小鼠的多器官损伤,包括内皮损伤、血管内凝血和继发性炎症。在体内多器官组织中,SiNPs降低了VE-cadherin的表达,改变了VE-cadherin的空间分布。
由此说明SiNPs暴露导致的损伤可能是由上游Ca2+-ROS信号通路和下游VE-cadherin磷酸化破坏以及F-actin重构所引起。基于本研究的发现将有助于更好地理解SiNPs的生物毒性,并开发相关的转化途径。
(图文/王昭君)
