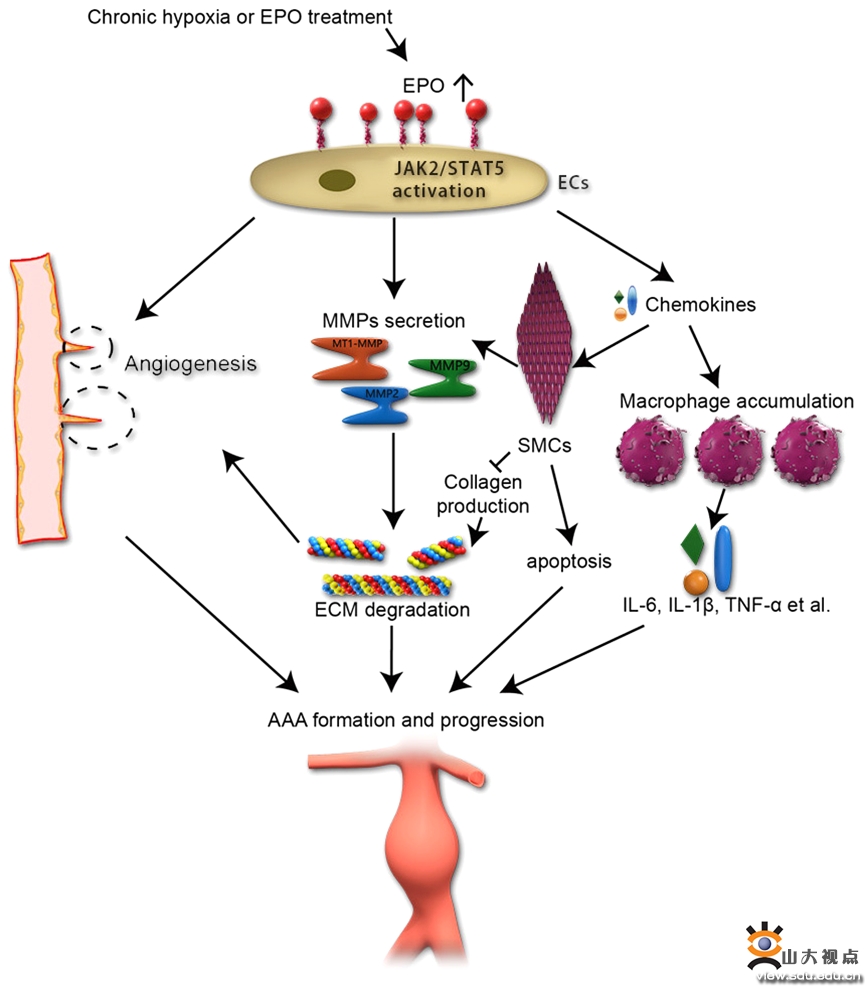
腹主动脉瘤(AAA)是一种潜在的致命性大血管疾病,一旦发生破裂,死亡率高达85%-90%。然而,AAA的发病机制一直未明,导致治疗药物的缺如。建立与人类AAA近似的动物模型,是进行AAA基础研究的前提。目前,Daugherty教授发明的血管紧张素II(Ang II)注射模型是最常用的AAA小鼠模型。然而,该模型必须使用高胆固醇血症的小鼠和超高剂量的Ang II,与临床疾病差距较大,由此得出的干预靶点临床试验无效。心内科博士生章萌在研究中首次发现,促红细胞生成素(EPO)不仅可剂量依赖性地诱导ApoE-/-小鼠发生AAA,同样可诱导野生型小鼠发生AAA,尤其在高剂量EPO组,二者AAA的发生率相似,从而建立了一个与人类AAA更为相似的动物模型。在课题组专家指导下,章萌对该模型的病理和发病机制进行了深入研究,发现EPO诱导的AAA中出现了血管新生、炎症浸润、细胞外基质降解、胶原合成减少、平滑肌细胞凋亡和夹层内血栓形成等病理过程,与人类AAA的病理改变极为相似。体外和离体实验表明,EPO通过JAK2/STAT5信号通路诱导内皮细胞的增殖、迁移和小管形成。临床研究发现,AAA患者的血清EPO浓度显著高于健康个体,并与AAA的大小高度相关。该研究成果提示,血清EPO在AAA发生和发展中起到了重要作用。临床上EPO主要用于治疗慢性肾功能衰竭或恶性肿瘤继发重度贫血的病人,对于需要长期EPO治疗的患者,应定期监测AAA的发生。此外,对生活在高海拔地区或处于慢性缺氧环境的人群,由于血清EPO水平升高,应定期进行AAA的筛查。在治疗学方面,针对EPO/EPOR相关信号通路的干预,有可能成为防治AAA的重要靶标。7月22日,本研究成果发表在国际著名期刊《科学转化医学》(Science Translational Medicine)上,该刊是国际著名杂志《科学》(Science)的重要子刊,中科院1区期刊,最新影响因子17.956,国内外媒体对此原创性成果进行了大量报道。山东大学齐鲁医院为第一和通讯作者单位,齐鲁医院心内科章萌医师为该论文的第一作者,张澄教授、张运院士和张猛教授为共同通讯作者。
文章链接:https://pubmed.ncbi.nlm.nih.gov/34290056/
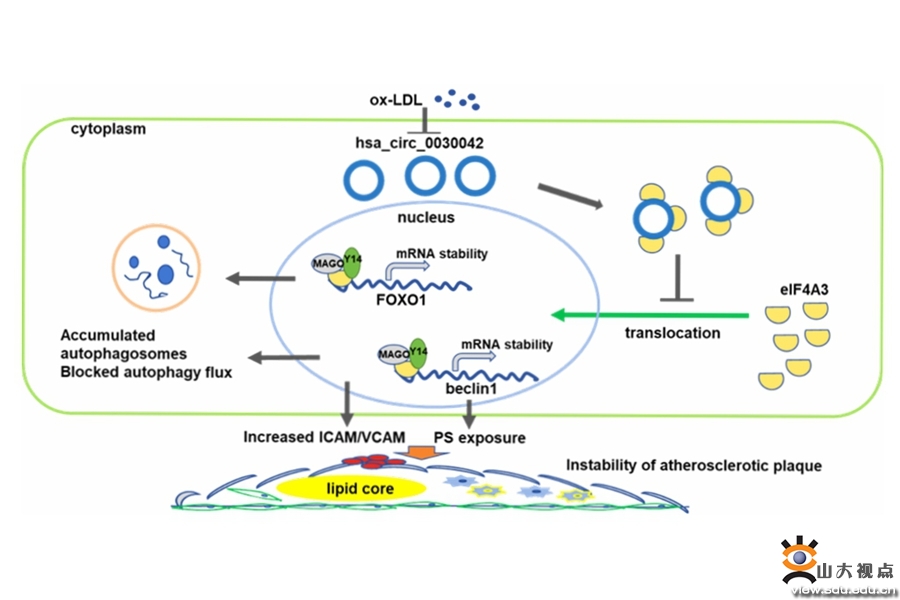
第二项研究成果涉及环状RNA(circRNA)调节细胞自噬和血管内皮功能的作用和机制。环状RNA是区别于传统线性RNA的一类新型RNA,具有闭合环状结构,大量存在于真核转录组中。circRNA作为新型调控型长链非编码RNA,在自噬调控中的作用逐渐显现,但circRNA在冠心病发病中的作用尚未明了。张澄教授课题组在冠心病和对照组受试者中采集外周血样本,采用高通量测序获得了冠心病相关的circRNA差异表达谱,并通过染色质免疫共沉淀及原位杂交等技术,发现在血管内皮细胞中冠心病相关的circ0030042可通过竞争性吸附RNA结合蛋白eIF4A3,影响eIF4A3与下游beclin1和FOXO1的mRNA相结合,降低自噬促进基因beclin1和FOXO1 mRNA稳定性,进而发挥抑制自噬的作用。在ApoE-/-小鼠体内研究中,circ0030042可减少动脉粥样硬化斑块的脂质面积,改善血管内皮依赖性舒张功能,增加斑块的稳定性。体外研究中,高浓度的氧化低密度脂蛋白可激活内皮细胞的异常自噬,导致内皮细胞死亡,而circ_0030042可抑制这一过程。该研究为动脉粥样硬化性心血管疾病的干预提供了新的靶点,论文发表于《治疗诊断学》(Theranostics),中科院1区期刊,最新影响因子11.556。山东大学齐鲁医院为第一和通讯作者单位,齐鲁医院心内科于方璞医师为第一作者,张澄教授为通讯作者。
文章链接:https://pubmed.ncbi.nlm.nih.gov/33859754/
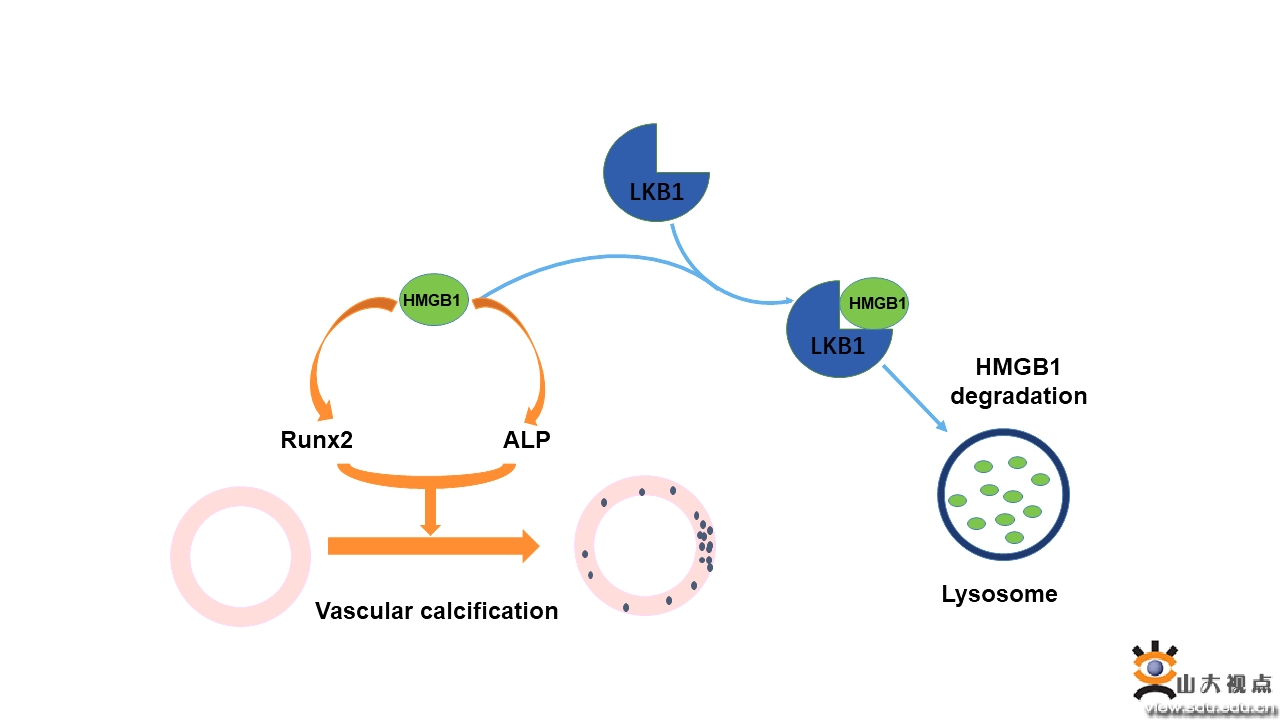
第三项研究成果涉及血管钙化的发生机制。血管钙化常见于动脉粥样硬化,病理学表现为血管组织中钙和磷的过度沉积,导致血管僵硬度升高和斑块不稳定,进而诱发心肌梗死和缺血性脑卒中。目前认为,血管钙化是一种可干预的主动性病理过程,而血管平滑肌细胞向成骨细胞的转化是最重要的发病环节,主要表现为平滑肌特异性基因(如α-SMA和SM22等)的表达下降和成骨性特异性基因(如Runx2、Msx2、ALP等)的表达上调。由于多种因素可参与血管钙化的进程,血管钙化的具体机制仍未阐明。LKB1是一种重要的蛋白激酶,可直接磷酸化并激活AMPK家族,从而发挥多种生物学功能。心血管实验室张文程教授的前期研究发现,在小鼠中敲除LKB1基因可升高血压、促进血管新生和肿瘤发生和诱发腹主动脉瘤,论文分别发表在Circulation、Oncogene和J Mol Cell Cardiol等国际著名杂志,但LKB1在血管钙化中的作用尚无报道。张文程教授和张澄教授领导的课题组成功构建了血管平滑肌细胞LKB1基因特异性敲除小鼠,发现在维生素D诱导的血管钙化模型中,LKB1敲除明显促进了小鼠血管钙化的程度,而LKB1过表达则显著抑制了高磷对血管平滑肌钙化的诱导作用。深入研究发现, LKB1可与高迁移率族蛋白B1直接结合,并通过溶酶体途径促进其降解,从而抑制血管钙化。临床研究证实,与正常人群相比,血管钙化患者组织中LKB1的水平明显下降。该研究进一步阐明了血管钙化的发病机制,证实了LKB1可抑制血管平滑肌的钙化,为临床预防和治疗血管钙化提供了一个新的干预靶点。该研究发表于《氧化还原生物学》(Redox biology)杂志,中科院1区期刊,最新影响因子11.799。山东大学齐鲁医院为第一和通讯作者单位,心内科博士生张天然为第一作者,张文程教授和张澄教授为共同通讯作者。
文章链接:https://pubmed.ncbi.nlm.nih.gov/33338919/
