开发具有多重响应性、抗菌性和生物相容性等多功能智能水凝胶是生物材料领域,尤其是纤维素基载药系统的研究热点。虽然CNF基水凝胶在药物缓释中的应用很有前景,但其药物释放初期的突释问题仍有待解决,而且针对特定药物的缓释时间也有待进一步提高。
近日,青岛能源所崔球研究员带领的代谢物组学研究组和天津科技大学的相关科研人员合作,以水溶性广谱抗生素——盐酸四环素为模型药物,基于前期对CNF和聚多巴胺(PDA)复合材料对改善药物缓释和促进伤口修复的研究(ZL201710612434.0;Carbohydrate Polymers, 2018, 188, 27-36;ChemistrySelect, 2018, 3, 6852-6858),构筑了一种新型的CNF基载药包封结构,可实现对药物的智能可控释放。研究人员首先制备了多孔聚多巴胺纳米颗粒(MPDA),将其对药物进行负载,然后用氧化石墨烯(GO)对其进行包裹,再将GO包裹的MPDA封装于由物理交联作用形成的CNF水凝胶中,制得MPDA@GO/CNF复合水凝胶材料。在该封装结构设计中(如图1所示),GO用于包裹MPDA,既可起到降低药物突释、延长药物缓释和增强复合水凝胶的作用,又可协同MPDA赋予复合水凝胶近红外光响应性。此外,CNF提供的3D网络结构作为第二层的封装,既有利于进一步降低药物突释和延长药物缓释,也可起到屏蔽GO本身毒性的作用,使最终的复合水凝胶具有非常好的细胞相容性。
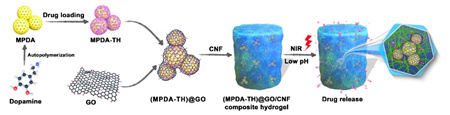
图1. MPDA@GO/CNF复合水凝胶包封结构的设计及其可控药物缓释应用
实验结果显示,该复合水凝胶的机械强度是纯CNF水凝胶的5倍,其药物缓释时间分别是PDA/CNF复合水凝胶和纯CNF水凝胶的3倍和7.2倍,且其药物的可控释放行为可通过改变MPDA和GO的比例来进行调节。此外,该复合水凝胶材料具有敏感的近红外光响应和pH响应的可控释放特性,其药物缓释初始阶段的突释性也明显优于其它同类材料。因此,这种新型的CNF基载药包封结构的设计,将有利于新型智能载药材料的开发,并有望替代传统的石油基材料载药系统,用于化学和物理治疗等。相关研究成果发表在ACS Applied Materials & Interfaces(2020, DOI: 10.1021/acsami.0c15465)期刊上,通讯作者是刘莹莹博士和李滨副研究员。
相关系列研究得到了国家自然科学基金、国家重点研发计划和山东省自然科学****基金的支持。(文/图 李滨 刘莹莹)
原文链接:https://doi.org/10.1021/acsami.0c15465
Yingying Liu*, Qing Fan, Ying Huo, Chao Liu, Bin Li*, and Youming Li. Construction of a Mesoporous Polydopamine@GO/Cellulose Nanofibril Composite Hydrogel with an Encapsulation Structure for Controllable Drug Release and Toxicity Shielding. ACS Applied Materials & Interfaces, 2020, DOI: 10.1021/acsami.0c15465.
附件下载:
