染色质是真核生物的生命蓝图。染色质重塑蛋白利用ATP水解的能量,改变染色质结构,参与生命蓝图的绘制和重绘。ISWI是多个染色质重塑复合物的催化亚基。ISWI驱动核小体在基因组DNA上滑动,调控基因转录、异染色质形成、X-染色体失活以及其它重要的染色质活动。ISWI蛋白的催化核心是一个自主的染色质重塑分子机器,其运作受严格的调控。ISWI活性受到AutoN结构域和NegC结构域的抑制作用,确保ISWI分子机器在没有结合底物时不会消耗ATP的能量。这些抑制作用分别被底物核小体的组蛋白H4尾巴和接头DNA拮抗。然而,组蛋白H4的乙酰化修饰削弱其对ISWI激活,这些多层次的调控作用确保细胞形成正确的高级染色质结构,保证正常的生命活动。
该研究揭示了ISWI的AutoN包含两个抑制元件,均与core2结合,使得ISWI处于抑制状态。组蛋白H4尾巴与core2的一个负电荷表面结合,与其中一个AutoN抑制元件有竞争关系,从而解析了H4激活ISWI以及乙酰化作用细调ISWI活性的分子机理。进一步生化研究表明ISWI蛋白的NegC与core2存在相互作用,这种相互作用是ISWI蛋白通过HSS结构域感知接头DNA长度、发挥染色质组装功能的分子基础。(生命科学部 供稿)
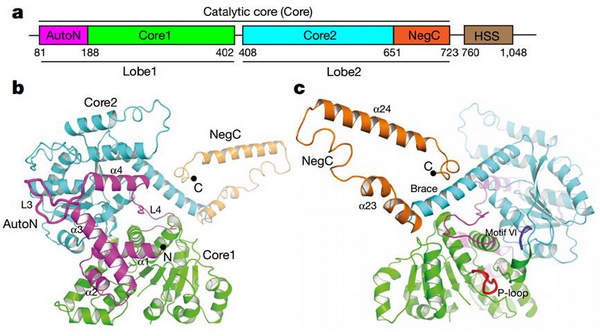
图:嗜热酵母ISWI蛋白的晶体结构
原文链接:http://www.nature.com/nature/journal/vaop/ncurrent/full/nature20590.html
