团队利用代谢组学技术,筛查了4590种差异代谢产物,绘制了肿瘤细胞和正常细胞的代谢差异图谱,发现肿瘤细胞内糖酵解水平明显高于正常细胞。该差异化的代谢模式引起肿瘤细胞胞质NAD+池水平升高约4.5倍。更重要的是,在原位癌发生早期,细胞即出现代谢模式由线粒体内的有氧磷酸化向胞质内糖酵解过程的转变。因此,实现胞质内糖酵解过程中重要标志物NAD+的细胞内侦测可实现肿瘤早期可视化预警。联合研究团队通过石墨烯量子点结构设计实现其与胞质内NAD+之间的荧光共振能量转移,进而实现细胞质内糖酵解过程的可视化荧光侦测。结果表明,基于荧光共振能量转移作用的传感过程,NAD+可特异性地将石墨烯量子点的荧光强度增强至原强度6倍以上。在小鼠肝脏自发瘤模型中,现有成像技术可在药物诱导24周后实现原位肿瘤病灶的检测。相比之下,基于N-CDs的成像策略,可在药物诱导20周即实现原位微小病灶的荧光标记,检测时间大幅提前4周。(图1)。
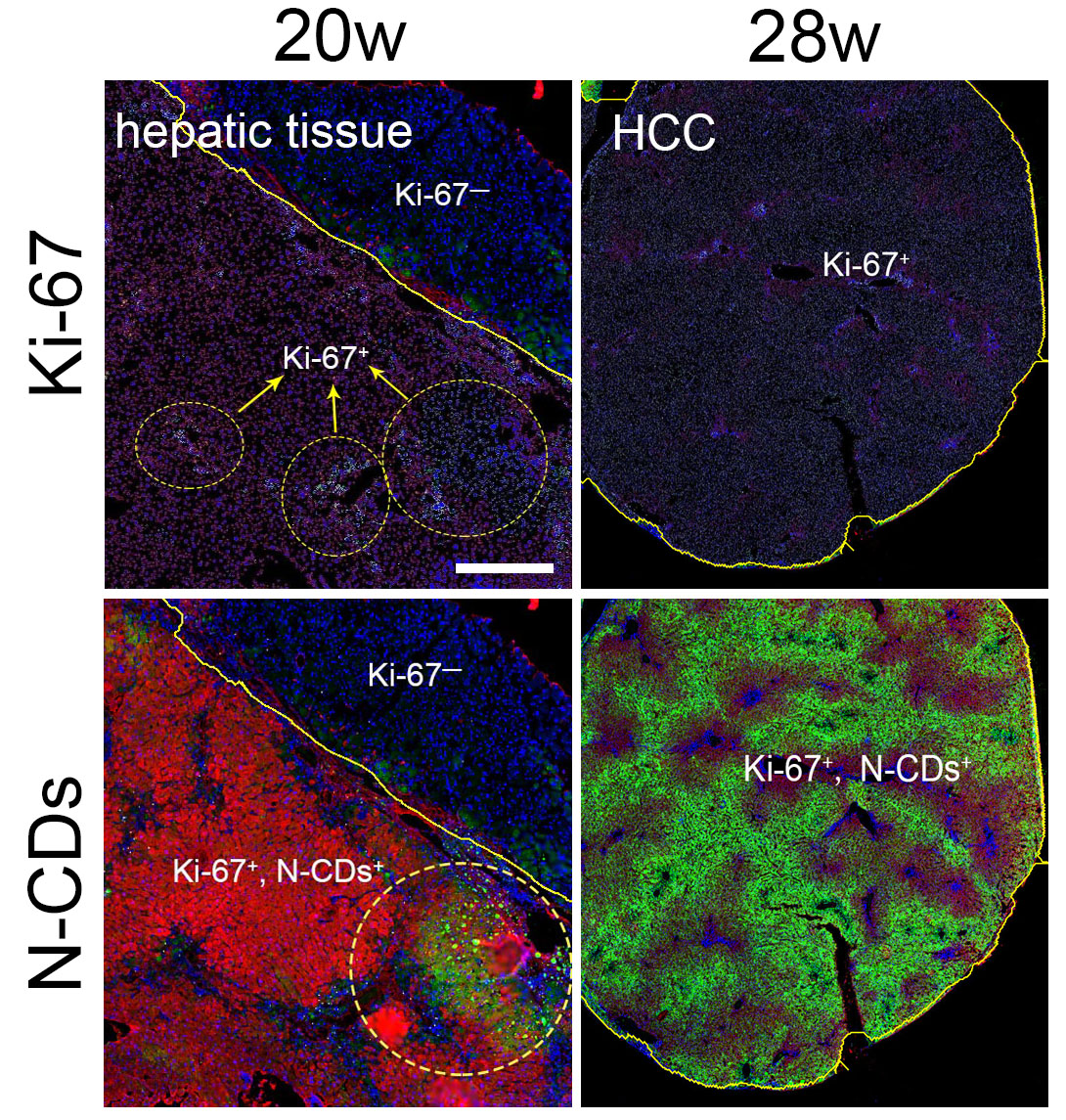
图1. 药物诱导下小鼠肝脏自发瘤模型中肝脏的Ki67染色及石墨烯量子点染色结果
此外,联合研究团队基于上述进展进一步开发了可用于肿瘤临床诊断的快速诊断试剂盒原型。该试剂盒对至少13种肿瘤细胞系的特异性标记率高达96.15%。最后,团队利用N-CDs对所收集的49例尿液、胸水、玻璃体和血液等临床样本进行肿瘤细胞筛查。结果表明,N-CDs可高效甄别样本中的肿瘤细胞,提示样本来源的患者可能具有泌尿系统、呼吸系统及视觉系统原发肿瘤病灶或多系统转移病灶的存在。在临床样本的肿瘤细胞检测中,该技术检测具有时间短(1小时出报告)、操作简易(具有标准化流程),精度高(单细胞水平)和准确性好(准确性>79.31%)等优势。
该研究结果提示N-CDs在微小肿瘤病灶的原位早期检测中发挥了重要作用,同时为肿瘤患者术中转移病灶的探查,健康人群尿液等肿瘤筛查提供了原型试剂盒,具有广阔的市场前景。相关研究成果以“Imaging Cellular Aerobic Glycolysis Using Carbon Dots for Early Warning of Tumorigenesis”为题在线发表于Advanced Materials (IF=27.398)。论文第一作者为上海九院博士生李吉鹏和中科院上海微系统所助理研究员杨思维博士,通讯作者为上海交通大学医学院附属第九人民医院眼科范先群教授、周慧芳教授,中科院上海微系统所丁古巧研究员和苏州大学康振辉教授。基于上述研究成果,联合研究团队申请两项国家发明专利(申请号:202011164540.5, 202011222226.8),提出并建立了“基于碳氮荧光量子点的有氧糖酵解检测技术”和“碳氮量子点肿瘤细胞检测技术”两项领先技术,并已经与药企积极沟通,推进科技成果市场转化。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202005096
| 附件下载: |
