

东北大学 冶金学院,辽宁 沈阳 110819
收稿日期:2022-03-08
基金项目:国家自然科学基金资助项目(U1908225,U1702253, U1903129);中央高校基本科研业务费专项资金资助项目(N182515007,N170908001,N2025004)。
作者简介:闫基森(1993-),男,河南南阳人,东北大学博士研究生;
豆志河(1978-),男,河南周口人,东北大学教授,博士生导师;
张廷安(1960-),男,河南周口人,东北大学教授,博士生导师。
摘要:对多级深度还原法制备Ti6Al4V合金粉体过程中的镁热自蔓延产物的浸出过程进行了研究, 探究了原料粒度、浸出温度和盐酸浓度对浸出过程的影响. 结果表明, 温度和盐酸浓度对Ti的浸出率有很大的影响.Mg浸出反应的表观活化能为47.38 kJ/mol, 反应级数为0.22.Ti浸出反应的表观活化能为103.4 kJ/mol, 反应级数为1.142.最终选择D50为59.4 μm的镁热自蔓延产物作为原料, 采用30 ℃的浸出温度和1 mol/L的盐酸作为浸出条件.经过180 min的浸出可将镁热自蔓延产物中的Mg去除92.1 %, 钛的损失率为17.5 %.
关键词:多级深度还原酸浸Ti6Al4V合金粉体镁热自蔓延反应动力学
Leaching Kinetics of Magnesiothermic Self-propagating Products in Preparation of Ti6Al4V Powder by Multistage Deep Reduction Method
YAN Ji-sen, DOU Zhi-he, ZHANG Ting-an


School of Metallurgy, Northeastern University, Shenyang 110819, China
Corresponding author: ZHANG Ting-an, E-mail: zta2000@163.com.
Abstract: The leaching process of magnesiothermic self-propagating products in the preparation of Ti6Al4V alloy powder by multi-stage deep reduction method was studied. The effects of raw material particle size, leaching temperature and hydrochloric acid concentration on the leaching process were studied. The results show that temperature and hydrochloric acid concentration have a great influence on the leaching rate of Ti. The apparent activation energy of the Mg leaching reaction was 47.38 kJ/mol, and the reaction order was 0.22. The apparent activation energy of Ti leaching reaction was 103.4 kJ/mol, and the reaction order was 1.142.Finally, the magnesiothermic self-propagating product with D50 of 59.4 μm was selected as the raw material, and the leaching temperature of 30 ℃ and the hydrochloric acid of 1 mol/L were used as the leaching conditions.After 180 min of leaching, 92.1 % of Mg in the magnesiothermic self-propagating product can be removed, and the loss rate of titanium was 17.5 %.
Key words: multistage deep reductionacid leachingTi6Al4V alloy powdermagnesiothermic self-propagating reactionkinetics
钛合金具有比强度高、耐腐蚀以及生物相容性好等优异特点而被广泛应用[1].随着时代的发展和人类生活水平的提高, 市场对钛材的需求更加迫切, 2015年全球钛材加工产量仅为2.9万t, 而2019年则增长至15万t[2].但高昂的生产成本始终限制着钛合金应用范围的进一步扩大.海绵钛的生产成本占钛材总成本的30 % ~40 %, 在航空航天领域, 海绵钛占原材料成本的46 %, 如果钛合金成本能够降低50 %, 则它的用量将会提高5~10倍.
海绵钛的生产方法最早是由Kroll提出的, 也是目前唯一大规模生产海绵钛的方法, 使用这种方法可生产出杂质含量极低的海绵钛.但该方法只能间歇式生产, 对设备要求极高, 生产周期长,导致生产成本高.直接使用TiO2制备钛合金可以避免氯化过程带来的一系列问题, 因此很多****对这种无TiCl4中间相的新方法展开了研究[3-7].
文献[8-10]提出了一种多级深度还原法制备钛和钛合金粉体的新工艺.该工艺使用TiO2, V2O5, Al为原料, 首先使用Mg作为还原剂进行镁热自蔓延初级还原, 然后将酸洗后的镁热自蔓延初级还原产物使用Ca进行深度还原[11].与其他的金属热还原工艺不同的是, 多级深度还原法充分考虑了Mg和Ca金属性的不同, 以及MgO和CaO酸碱性的差异, 在初级还原阶段选择Mg作为还原剂, 得到含MgO副产物的镁热自蔓延产物.去除MgO副产物后再进行Ca热深度还原得到最终产物.该工艺使钛材生产成本降低30 % 左右[12], 可以达到低成本清洁生产钛及钛合金粉体的目的.
Mg和Ca杂质会影响钛合金产品的机械性能[13].多级深度还原工艺涉及两个酸洗过程,分别为了去除MgO和Ca/CaO.本文对多级深度还原过程中含镁副产物的溶解过程进行了研究.与大多数研究单晶的溶解工艺不同, 本文在研究的过程中发现了多晶氧化镁晶体.使用盐酸溶液的原因是氧化镁溶解动力学的活化能在盐酸体系中最小[14].在酸浸过程中Ti不可避免地也会被浸出, 造成损失.本文研究温度、镁热自蔓延产物粒度和盐酸浓度对Mg和Ti的溶解过程的影响.
1 实验材料和实验方法多级深度还原法制备钛和钛合金粉体的工艺流程如图 1所示[11].本文对图 1中虚线部分的酸浸过程进行了研究.使用不同粒径的筛子将镁热自蔓延产物进行筛分, 分别得到D50为85.3, 59.4, 50.9和26.7 μm 4种粉体(命名为粒度1,粒度2,粒度3和粒度4), 如图 2所示.每次使用镁热自蔓延产物1.5 g和2 L盐酸溶液(溶液中盐酸的实际消耗量小于添加量的5 %, 且每次使用移液枪取溶液仅3~5 mL, 保证了实验过程中酸浓度和液固比基本不变).浸出实验在2 L的玻璃三口烧瓶内进行, 使用聚四氟乙烯材质的搅拌桨(展开半径为3 cm, 搅拌转速为250 r/min)进行搅拌.实验过程中用耐热塞子密封以防止盐酸溶液蒸发.使用5 mL的移液枪进行取样, 然后使用快速滤纸进行过滤.取样时间为实验开始后的1, 3, 5, 7, 10, 15, 30, 45, 60, 90, 120, 150和180 min.使用恒温水浴锅保证实验过程中液体处于稳定的温度场内.考察了盐酸浓度、酸洗温度和镁热自蔓延产物粒度对Mg和Ti的浸出率的影响.
图 1(Fig. 1)
 | 图 1 多级深度还原法工艺流程图Fig.1 Process flow chart of multistage deep reduction method |
图 2(Fig. 2)
 | 图 2 实验所用的镁热自蔓延产物粒度Fig.2 The particle size of the magnesiothermic self-propagating product used in the experiment (a)—粒度1;(b)—粒度2;(c)—粒度3;(d)—粒度4. |
实验过程中使用铜靶X射线衍射仪(XRD, Bruker, D8, Germany)对物相进行检测; 使用场发射扫描电子显微镜(SEM/EDS, SU8010, Hitachi, Japan)对产品的微观结构进行表征; 使用激光粒度分析仪(Master-sizer, 2000, UK)表征产品的粒度; 使用电感耦合等离子体光谱(ICP-AES, Leeman, Prodigy XP, US)法分析溶液中Ti和Mg的浓度.
2 结果与讨论2.1 浸出前后的物相以及形貌变化图 3为浸出前后产物的XRD图谱, 可以看出MgO的物相峰分别位于36.889°(111), 42.856°(200), 62.217°(220), 74.578°(311), 78.51°(222).因此MgO是初级还原阶段的主要含镁杂质.经过浸出后MgO的物相峰完全消失.
图 3(Fig. 3)
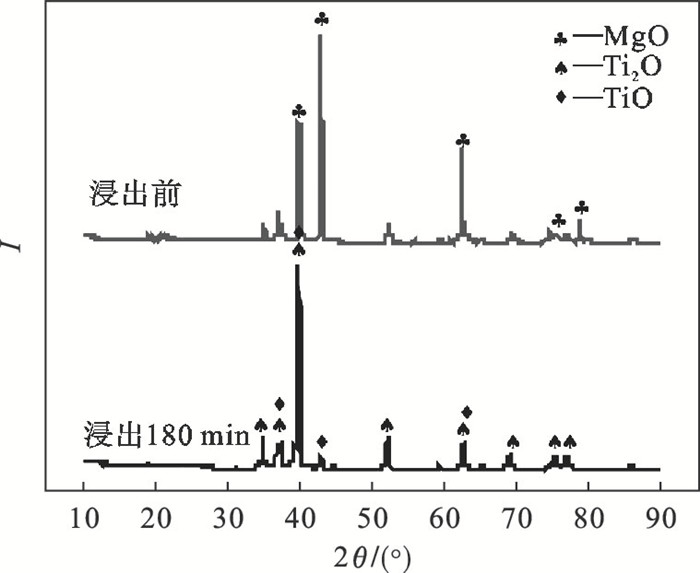 | 图 3 浸出前后产物的XRD分析Fig.3 XRD analysis of the products before and after leaching |
图 4a和图 4b分别为酸洗前后产物的微观形貌.可以看出酸洗前产物表面覆盖着细小的MgO颗粒, 酸洗后产物则呈多孔状形貌.
图 4(Fig. 4)
 | 图 4 产物的SEMFig.4 SEM of the products (a)—酸洗前;(b)—酸洗后. |
深度还原阶段使用Ca作为还原剂, 没有CaCl2和MgCl2等辅助盐类的添加.还原温度在800~1100 ℃.镁热自蔓延产物内部是富Mg区和钛基体相互包裹的状态.若不将MgO去除, 则O2-只有穿过富Mg区与Ca2+结合后才能达到深度脱氧的目的.因此十分有必要将黑色的Mg元素富集区去除, 增强深度还原阶段的传质效果.
2.2 浸出温度的影响当HCl浓度为1 mol/L,D50为85.3 μm时,浸出温度对Mg和Ti浸出率的影响如图 5所示.由图 5a可以看出,随着浸出温度的升高,相同时间内Mg的浸出率提高.浸出温度相同时, 随着浸出时间的增加,Mg的浸出速率逐渐变慢.图 5b是不同浸出温度下Ti的浸出率随时间的变化曲线.由图 5b可以看出,随着浸出温度的升高,相同时间内Ti的浸出率提高.与Mg的浸出过程相比, 相同浸出温度下随着浸出时间的增加,Ti的浸出率也逐步提高.当浸出时间达到60 min时, 4种不同温度的体系中Mg的浸出率均超过了50 %, 甚至达到了90 %, 而此时钛的浸出率分别为0.9 %, 4.0 %, 15.4 % 和30.7 %;当浸出时间超过90 min以后, 浸出温度为40, 50和60 ℃的三组溶液中Mg的浸出率变化极小, 而此时Ti的浸出率却不断增长.
图 5(Fig. 5)
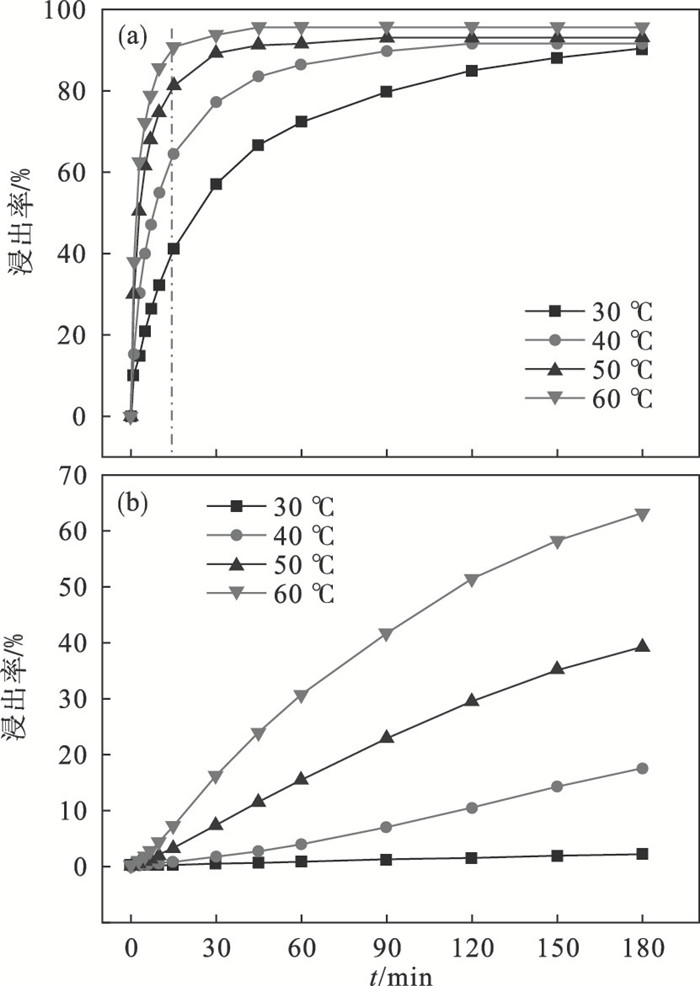 | 图 5 温度对Mg和Ti浸出率的影响Fig.5 Effect of temperatures on leaching rate of Mg and Ti (a)—Mg; (b)—Ti. |
2.3 镁热自蔓延产物粒度的影响当HCl浓度为1 mol/L,浸出温度为40 ℃时,镁热自蔓延产物粒度对Mg和Ti浸出率的影响如图 6所示.由图 6a可以看出, 随着镁热自蔓延产物粒度的减小, 相同时间内Mg的浸出率提高.相同粒度下随着浸出时间的增加,Mg的浸出速率逐渐变慢.除了粒度1外, 其他3组实验最终Mg的浸出率几乎相同, 达到95 % 左右.由图 6b可以看出, 随着镁热自蔓延产物粒度的减小, 相同时间内Ti的浸出率提高.当浸出时间为180 min时, 4种粒度下Ti的浸出率分别达到17 %, 17.5 %, 21.1 % 和22.2 %.说明随着镁热自蔓延产物粒度的减小, 相同酸浓度条件下会造成Ti损失量的增加.
图 6(Fig. 6)
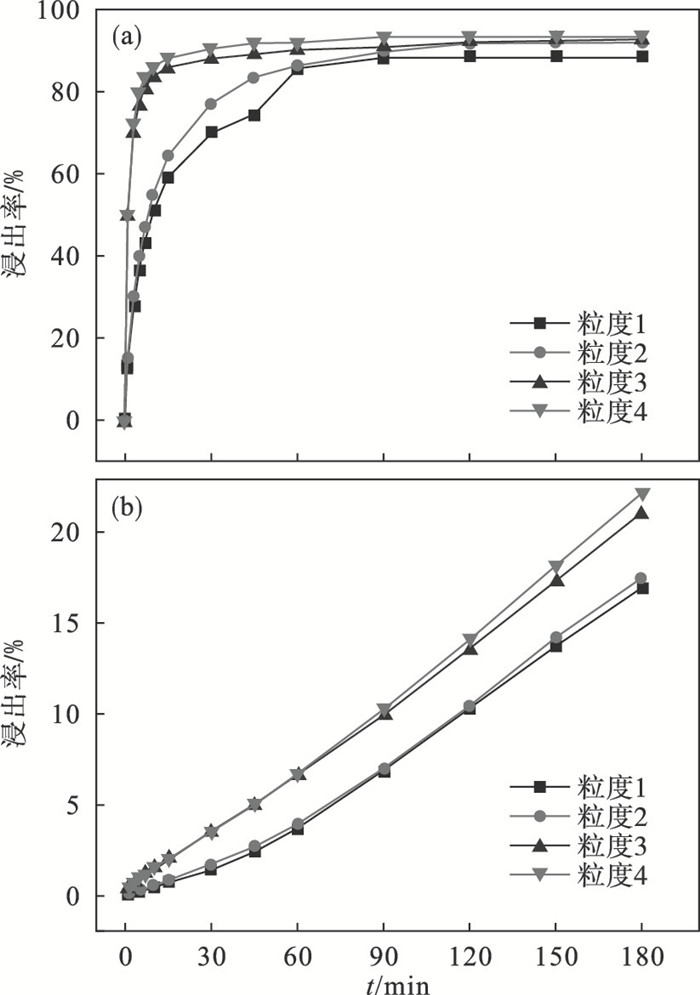 | 图 6 镁热自蔓延产物粒度对Mg和Ti浸出率的影响Fig.6 Effect of particle size of magnesiothermic self-propagating products on leaching rate of Mg and Ti (a)—Mg; (b)—Ti. |
2.4 盐酸浓度的影响当浸出温度为40 ℃,镁热自蔓延产物粒度为59.4 μm时,盐酸浓度对Mg和Ti浸出率的影响如图 7所示.通过图 7a可以看出,Mg的浸出过程大多发生在60 min以前.当浸出时间达到60 min时, 盐酸浓度分别为4, 3, 2, 1 mol/L时,Mg的浸出率分别为95.3 %, 90.4 %, 88.3 % 和86.4 %;当浸出时间达到180 min时, Mg的浸出率分别为97.6 %, 97.1 %, 97 % 和92.1 %.说明当浸出液中的盐酸浓度增加至2 mol/L以上时, 继续增加溶液中的盐酸浓度, 则对产物中Mg的浸出过程影响不大.通过图 7b可以看出, 随着溶液中盐酸浓度的提高, 相同时间内Ti的浸出率提高.当浸出时间为180 min时, 溶液中盐酸浓度分别为4, 3, 2, 1 mol/L时, Ti的浸出率分别达到60 %, 55.6 %, 44.3 % 和17.5 %, 说明在酸浸的过程中过高的盐酸浓度会造成Ti的损失率增加.
图 7(Fig. 7)
 | 图 7 盐酸浓度对Mg和Ti浸出率的影响Fig.7 Effect of hydrochloric acid concentration on leaching rate of Mg and Ti (a)—Mg; (b)—Ti. |
通过对比可知温度和盐酸浓度对Ti的浸出率影响极大.
2.5 浸出动力学分析为了研究镁与浸出液相互作用的本质, 利用不同的模型对不同温度下的动力学数据进行了拟合.从镁热自蔓延产物中浸出金属元素属于固液非均相反应, 它发生在未反应粒子的表面.随着MgO以及其他金属氧化物的连续浸出, 反应界面向内收缩, 残存的固体物质形成多孔结构.浸出动力学符合未反应收缩核模型[15-17].化学反应模型和扩散控制模型分别为
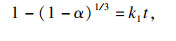 | (1) |
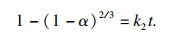 | (2) |
表 1(Table 1)
| 表 1 在不同浸出温度下Mg的浸出三种动力学模型的相关系数(R2) Table 1 Correlation coefficients (R2) of the three kinetic models of the leaching of Mg at different leaching temperatures | |||||||||||||||||||||||
图 8(Fig. 8)
 | 图 8 分段拟合不同温度下镁的浸出率Fig.8 Segmental fitting of magnesium leaching rates at different temperatures (a)—化学反应模型;(b)—扩散控制模型. |
Avrami方程最早用于描述多相复杂反应过程中晶体长大的动力学过程, 之后在湿法冶金领域被用于描述多种金属或金属氧化物的浸出过程, 如式(3)所示.在浸出过程中MgO连续溶解且无固相生成, 因此可视为反结晶过程.因此,Avrami方程也适用于这一过程[18-19].
 | (3) |
表 2(Table 2)
| 表 2 在不同盐酸浓度下Mg的浸出三种动力学模型的相关系数(R2) Table 2 Correlation coefficients (R2) of the three kinetic models of the leaching of Mg at different hydrochloric acid concentrations | |||||||||||||||||||||||
图 9(Fig. 9)
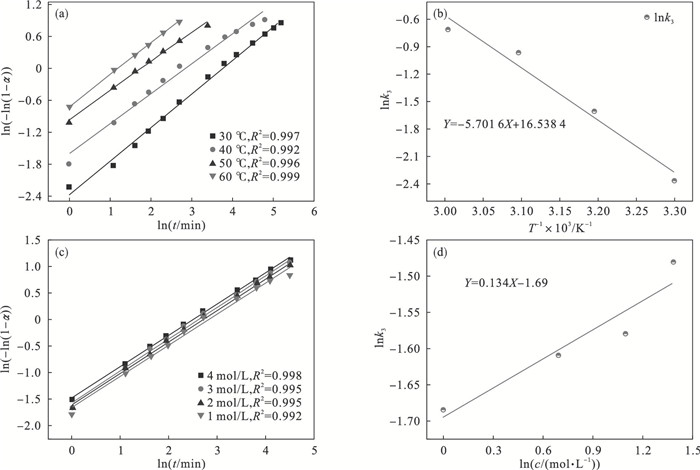 | 图 9 Mg的浸出率关系表达式Fig.9 Expression of leaching rate of Mg (a)—不同温度下Mg的浸出率ln(-ln(1-α))与lnt关系; (b)—Mg浸出率的Arrhenius拟合关系; (c)—不同盐酸浓度情况下Mg的浸出率ln(-ln(1-α))与lnt关系; (d)—Mg浸出过程中的lnk3与lnc关系. |
根据式(4)的Arrhenius公式, 将lnk3对1/T作图可以得到图 9b, 将其拟合成线性关系可以得到反应的表观活化能.经计算可知,浸出液中的盐酸浓度为1 mol/L时, Mg浸出反应的表观活化能为47.38 kJ/mol.
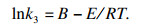 | (4) |
为了求出盐酸溶液中Mg浸出反应的反应级数, 对图 7a中不同盐酸浓度下Mg的浸出数据进行拟合, 其中不同动力学模型下拟合的相关系数如表 2和图 9c所示.拟合结果表明Avrami方程对Mg的浸出过程的拟合效果好于其他两种模型.
根据式(5), 将lnk3对lnc作图可以得到图 9d, 将其拟合成线性关系可以得到浸出反应的反应级数.图 9d中拟合直线的斜率即为盐酸浸出Mg的反应级数n.经计算可知, 不同盐酸浓度下浸出Mg的反应级数为0.22.说明增加盐酸浓度对Mg的浸出速率无明显影响.
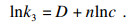 | (5) |
为了探究盐酸浸出过程中Ti的浸出动力学问题, 将不同温度和盐酸浓度下Ti的浸出率数据代入不同的动力学函数中进行拟合, 计算结果如表 3所示.通过表 3可以看出, 当使用式(1)化学反应控制模型进行拟合时, 所有条件下数据的相关系数R2≥0.99.说明实验过程中Ti的浸出过程符合化学反应控制模型, 如图 10a和图 10b所示.
表 3(Table 3)
| 表 3 不同浸出温度下Ti的浸出在不同动力学模型下拟合的相关系数(R2) Table 3 Correlation coefficient (R2) of the leaching of Ti fitted under different kinetic models at different leaching temperatures | |||||||||||||||||||||||||||||||||||||||||||
图 10(Fig. 10)
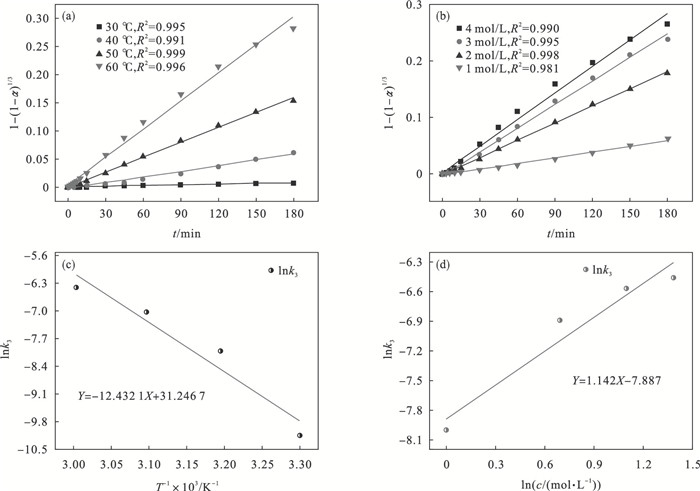 | 图 10 Ti的浸出率关系表达式Fig.10 Expression of leaching rate of Ti (a)—不同温度下Ti的浸出率1-(1-α)1/3与t关系; (b)—不同盐酸浓度情况下Ti的浸出率1-(1-α)1/3与t关系; (c)—Ti浸出速率的Arrhenius拟合关系; (d)—Ti浸出过程中的lnk3与lnc关系. |
根据式(4)的Arrhenius公式, 将lnk3对1/T作图可以得到图 10c, 将其拟合成线性关系可以得到反应的表观活化能.经计算可知, 浸出液中的盐酸浓度为1 mol/L时, Ti浸出反应的表观活化能为103.4 kJ/mol.按Arrhenius公式求出的表观活化能大于41.8 kJ/mol, 说明Ti的浸出过程确实符合化学反应控制.根据式(5)将lnk对lnc作图可以得到图 10d, 将其拟合成线性关系可以得到反应的反应级数.图 10d中拟合直线的斜率即为盐酸浸出Ti的反应级数n.经计算可知, 不同盐酸浓度浸出Ti的反应级数为1.142(不同盐酸浓度浸出Mg的反应级数仅为0.22).说明增加盐酸浓度对Ti的浸出有明显的促进作用.
3 结论1) Mg的浸出动力学数据符合Avrami方程, 经计算可知,盐酸浓度为1 mol/L时, Mg浸出反应的表观活化能为47.38 kJ/mol.不同盐酸浓度下浸出Mg的反应级数为0.22.
2) Ti的浸出过程符合化学反应控制模型.经计算可知, 盐酸浓度为1 mol/L时, Ti浸出反应的表观活化能为103.4 kJ/mol.不同盐酸浓度下浸出Ti的反应级数为1.142.
3) 通过反应级数的对比可知, 增加盐酸浓度对Ti的浸出率有很大影响.选择D50为59.4 μm的镁热自蔓延产物作为原料, 采用30 ℃的浸出温度和盐酸浓度为1 mol/L作为浸出条件, 经过180 min的浸出可将镁热自蔓延产物中92.1 % 的Mg去除, Ti的损失率为17.5 %.
参考文献
| [1] | 蔡景治, 苑春苗, 孟凡一, 等. 微米和纳米钛粉尘层着火蔓延特性研究[J]. 东北大学学报(自然科学版), 2020, 41(1): 137-142. (Cai Jing-zhi, Yuan Chun-miao, Meng Fan-yi, et al. Study on ignition and flame spread characteristics of micron and nano titanium dust layers[J]. Journal of Northeastern University(Natural Science), 2020, 41(1): 137-142.) |
| [2] | 贾翃, 逯福生, 郝斌. 2016年中国钛工业发展报告[J]. 钢铁钒钛, 2017, 38(3): 1-7. (Jia Hong, Lu Fu-sheng, Hao Bin. 2016 China titanium industry development report[J]. Iron Steel Vanadium Titanium, 2017, 38(3): 1-7.) |
| [3] | 李亮, 李开华, 苗庆东, 等. 海绵钛生产过程还原周期影响因素研究[J]. 有色金属(冶炼部分), 2015(8): 27-30. (Li Liang, Li Kai-hua, Miao Qing-dong, et al. Analysis on influence factors for period of reduction process in titanium sponge production[J]. Nonferrous Metals(Extractive Metallurgy), 2015(8): 27-30. DOI:10.3969/j.issn.1007-7545.2015.08.007) |
| [4] | Cheng C, Dou Z H, Zhang T A, et al. Synthesis of as-cast Ti-Al-V alloy from titanium-rich material by thermite reduction[J]. JOM, 2017, 69(2): 1818-1823. |
| [5] | Jia J G, Xu B Q, Yang B, et al. Behavior of intermediate CaTiO3 in reduction process of TiO2 by calcium vapor[J]. Key Engineering Materials, 2013, 551: 25-31. DOI:10.4028/www.scientific.net/KEM.551.25 |
| [6] | Okabe T H, Oda T, Mitsuda Y. Titanium powder production by preform reduction process(PRP)[J]. Journal of Alloys & Compounds, 2004, 364(1/2): 156-163. |
| [7] | Zhang Y, Fang Z G, Xia Y. Hydrogen assisted magnesiothermic reduction of TiO2[J]. Chemical Engineering Journal, 2017, 308(15): 299-310. |
| [8] | Zhang T A, Dou Z H, Liu Y, et al. Method for preparing reduced titanium powder by multi-stage deep reduction: CN 107236869 A[P]. 2017-10-10. |
| [9] | Fan S G, Dou Z H, Zhang T A, et al. Deoxidation mechanism in reduced titanium powder prepared by multistage deep reduction of TiO2[J]. Metallurgical and Materials Transactions B, 2019, 50: 282-289. DOI:10.1007/s11663-018-1466-6 |
| [10] | Yan J S, Dou Z H, Zhang T A, et al. Basic research on preparation of Ti6Al4V alloy powder by multistage depth reduction process[J]. Rare Metal Materials and Engineering, 2021, 50(9): 3094-3101. |
| [11] | Yan J S, Dou Z H, Zhang T A, et al. A new method of preparing Ti6Al4V powder by a multistage depth reduction process[J]. Rare Metal Materials and Engineering, 2021, 50(8): 2973-2978. |
| [12] | 张廷安, 豆志河. 钛及钛合金的新型多级深度热还原技术[J]. 钛工业进展, 2020, 37(2): 43-48. (Zhang Ting-an, Dou Zhi-he. A novel multi-stage deep thermal reduction technology for titanium and its alloys[J]. Titanium Industry Progress, 2020, 37(2): 43-48.) |
| [13] | Fang Z Q, Wang Y Q, Zou Y Z, et al. One-pot synthesis of nickel sulfide with sulfur powder as sulfur source in solution and their electrochemical properties for hydrogen evolution reaction[J]. Inorganic Chemistry Communications, 2017, 79: 1-4. DOI:10.1016/j.inoche.2016.12.010 |
| [14] | Alena F, Raschman P. Effects of pH and acid anions on the dissolution kinetics of MgO[J]. Chemical Engineering Journal, 2008, 143(1/2/3): 265-272. |
| [15] | Yang S H, Li H, Sun Y W, et al. Recovery of Ti and Li from spent lithium titanate cathodes by a hydrometallurgical process[J]. Transactions of Nonferrous Metals Society of China, 2016, 26(6): 1688-1695. DOI:10.1016/S1003-6326(16)64278-4 |
| [16] | Kim E Y, Kim M S, Lee J C, et al. Leaching kinetics of copper from waste printed circuit boards by electro-generated chlorine in HCl solution[J]. Hydrometallurgy, 2011, 107(3/4): 124-132. |
| [17] | Behera S S, Parhi P K. Leaching kinetics study of neodymium from the scrap magnet using acetic acid[J]. Separation & Purification Technology, 2016, 160: 59-66. |
| [18] | Nizamettin D, As?m K. Dissolution kinetics of ulexite in perchloric acid solutions[J]. International Journal of Mineral Processing, 2007, 83(1/2): 76-80. |
| [19] | Li G H, Rao M J, Tao J, et al. Leaching of limonitic laterite ore by acidic thiosulfate solution[J]. Minerals Engineering, 2011, 24(8): 859-863. |
| [20] | Zhuang L Q, Sun C H, Zhou T, et al. Recovery of valuable metals from LiNi(0.5)Co(0.2)Mn(0.3)O2 cathode materials of spent Li-ion batteries using mild mixed acid as leachant[J]. Waste Management, 2019, 85: 175-185. |

