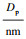, 李英楠, 樊瑞
, 李英楠, 樊瑞 东北大学 冶金学院,辽宁 沈阳 110819
收稿日期:2022-07-08
基金项目:国家自然科学基金资助项目(U1261120)。
作者简介:李凤华(1977-),女,湖北荆门人,东北大学副教授。
摘要:锰系锂离子筛适用于我国高镁锂比的盐湖提锂,针对MnSO4, MnOOH, Mn3O4三种不同锰源合成MnO2·0.5H2O锂离子筛,分析锰源对锂离子筛吸附性能的影响.采用XRD, SEM, BET, AAS技术手段对样品进行表征分析.实验结果表明,三种锰源均可合成较纯的Li1.6Mn1.6O4离子筛前驱体,酸洗脱锂后三种锂离子筛的BET比表面积相比先驱体均发生了大幅增加,增量分别为546.6%,129.9%, 142.2%.其中以MnSO4合成的离子筛比表面积最大,Mn3O4合成的离子筛成特殊棒状形貌.吸附结果表明,MnSO4源合成的离子筛锂吸附性量最高,在质量浓度仅20 mg/L的低锂溶液中,提锂量为19 mg/g.
关键词:锰源锂离子筛低温水热吸附性能提锂
Effects of Manganese Source on Synthesis and Adsorption Properties of Lithium Ion Sieve
LI Feng-hua, LIU Xiao

 , LI Ying-nan, FAN Rui
, LI Ying-nan, FAN Rui School of Metallurgy, Northeastern University, Shenyang 110819, China
Corresponding author: LIU Xiao, E-mail: isliuxiao1998@163.com.
Abstract: Manganese lithium ion sieve is suitable for extracting lithium from salt lakes with high magnesium lithium ratio in China. MnO2·0.5H2O lithium ion sieve were synthesized from three different manganese sources: MnSO4, MnOOH and Mn3O4. The products were characterized by X-ray diffraction (XRD), scanning electron microscope (SEM), special surface area analysis (the BET method), and atomic absorption spectrometer (AAS).The experimental results show that the three manganese sources can synthesize relatively pure Li1.6Mn1.6O4 ion sieve precursors. After acid pickling, the BET specific surface areas of the three lithium ion sieves have increased significantly compared with the precursors, with increments of 546.6%, 129.9% and 142.2% respectively. Among them, the ion sieve synthesized by MnSO4 has the largest specific surface area, and the ion sieve synthesized by Mn3O4 has a special rod shape. The adsorption results showed that the lithium adsorption capacity of the ion sieve synthesized by MnSO4 source was the highest. In the low lithium solution with a concentration of only 20 mg/L, the lithium extraction capacity was 19 mg/g.
Key words: manganese sourcelithium ion sievelow temperature hydrothermaladsorption performancelithium extraction
在全球能源危机与“双碳目标”政策背景下,新能源汽车产量大幅增长,锂需求剧增.我国矿石锂源储量低、开采能耗大,而液态锂资源储量丰富,约占锂总量85%[1],盐湖、海水提锂是获取锂资源的有效途径,具有重要战略意义和经济效益.
我国盐湖卤水镁锂比极高,镁和锂具有相似的化学性质,难以高效分离.锰基锂离子筛[2]是锂锰氧化物前驱体脱锂后的产物,其脱锂后结构中的空位对锂具有“记忆性”,仅容Li+再次进入.这种独特的锂选择性使离子筛吸附材料适用于我国镁锂比高的液态锂环境,且锰基的离子筛具有廉价、绿色的优点,是最具前景的提锂材料.
锂离子筛前驱体合成是将锰源(如MnO2,Mn2O3,MnCO3,Mn(NO3)2,Mn(CH3COO)2等)和锂源(如LiOH, Li2CO3, LiNO3等,其中LiOH较为常用),在一定温度时间下反应制得,常见的制备方法有高温固相法[3]、熔盐法[4]、水热法[5]等.其中,水热法具有产物尺寸均匀且有形貌规则的优点,产物最小粒度可达纳米级[2].
众多研究发现,不同的锰源合成的离子筛前驱体及离子筛吸附性能差别大.Hunter[6]发现锰源价态对反应影响显著;Sorour等[7]发现以MnCO3和MnO2为锰源,Li2CO3和LiOH为锂源制备的尖晶石型离子筛H1.1Li0.08Mn1.73O4.05时,当MnCO3和LiOH反应时离子筛吸锂性能最好;还有****制备了针状[5]、棒状[8]、枝条状[9]γ-MnOOH为锰源,与LiOH合成MnO2·0.5H2O的离子筛,在0.1,50,150 mg/L的锂溶液中吸附量分别为37,30.20,19.28 mg/g,吸附性能差异大,可见锰源的形貌、粒径也会影响吸附性能.同一种锰源的不同晶型也会对离子筛的合成造成不同结果,Yang等[4]发现锰源孔道大小对反应位阻及酸性位点分布有影响;Zhang等[10]证实斜方晶型MnO2制备的离子筛具有很强的选择性.
因此,锰源的化学组成与晶体结构对于锰系锂离子筛的合成以及吸附性能有至关重要的影响.本文采用水热法,探索MnSO4, MnOOH, Mn3O4三种锰源与LiOH·H2O锂源反应合成的MnO2·0.5H2O离子筛吸附性能,并从晶体结构、微观形貌等方面分析锰源的影响,为提高离子筛吸附性能提供参考路径.
1 材料与方法1.1 锰源的制备将1.58 g KMnO4(AR),2.1 g LiOH·H2O(AR),6 g MnSO4(AR)溶于50 mL去离子水中,制备MnOOH锰源.将上述LiOH·H2O换为2.8 g NaOH,可调节pH至12,制备Mn3O4锰源.将水热反应釜置于一体式马弗炉内,在160 ℃条件下反应8 h,冷却后,取出水热产物,用去离子水和乙醇分别清洗多遍,105 ℃下干燥12 h.
合成MnOOH与Mn3O4反应原理分别如式(1),式(2)所示:
 | (1) |
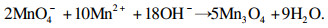 | (2) |
将上述实验得到的三种样品放于石墨坩埚中,在400 ℃下马弗炉中焙烧6 h,得到离子筛前驱体,分别记为LMO-MnSO4, LMO-MnOOH, LMO-Mn3O4.分别取0.2 g离子筛前驱体加入50 mL的0.5 mol/L的HCl,置于30 ℃振荡器中以150 r/min的速度往复振荡12 h,得到锂离子筛,分别记为LIS-MnSO4, LIS-MnOOH, LIS-Mn3O4.
1.3 离子筛吸附提锂实验将0.02 g离子筛放入50 mL的Li+质量浓度为20 mg/L的LiCl溶液中,用氨水调节pH至13,在30 ℃下以150 r/min的速度于振荡器中振荡.24 h后,测量上清液中Li+浓度.按式(3)计算锂离子筛对锂的吸附量:
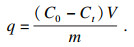 | (3) |
实验采用X射线衍射分析仪(XRD-7000,日本岛津仪器有限公司,Cu靶)表征样品的物相组成;用扫描电镜(Aprea 2c,赛默飞世尔科技有限公司)表征样品表明形貌;用比表面积分析仪(NOVA 2200E,美国康塔仪器公司)分析比表面积和孔径;用原子吸收分光光度计(TAS-990F,北京普析通用仪器有限公司)测试吸附液中锂浓度.
2 结果与讨论2.1 合成锰源的表征对不同pH下合成的锰源进行XRD物相分析,结果如图 1所示.在pH=6的酸性条件下,产物物相基本为γ-MnOOH(ICDD: 00-041-1379);pH调至12,产物主相为Mn3O4(ICDD: 00-001-1127),但在26.31°存在一些MnOOH杂相.结果表明,当KMnO4与MnSO4以1∶4的比例发生水热反应时,酸碱度的不同会使所得产物的晶相发生改变.水热过程中,碱性的增强抑制了KMnO4的氧化性,使得在pH=6时,将Mn氧化至3价;pH=12条件下只将Mn氧化至2.6价.马格等[11]在KMnO4与MnSO4以1∶4摩尔比碱性化溶液条件下,制得四价的MnO2.宋琳等[12]也借助氧化还原电势传感器证明了KMnO4氧化性在碱性条件下会减弱.因此,在KMnO4+MnSO4水热体系下可以通过调节溶液酸碱性来制备不同价态的锰源.
图 1(Fig. 1)
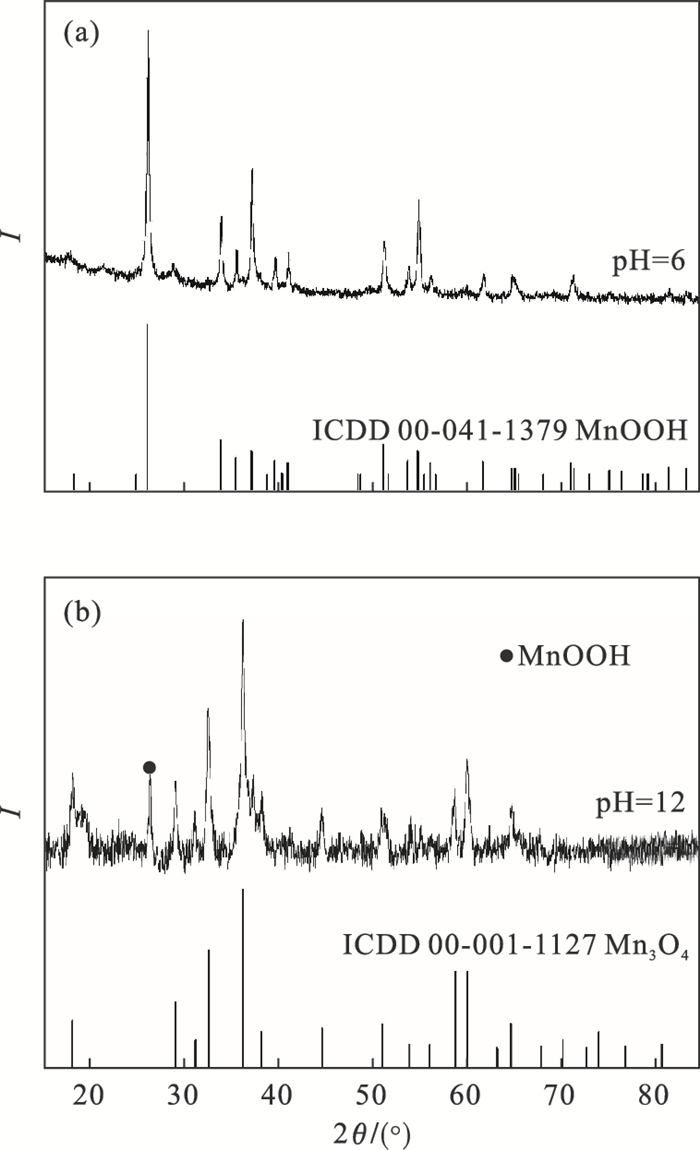 | 图 1 不同pH条件下以MnSO4为原料合成的锰源的XRD图Fig.1 XRD patterns of synthetic manganese source under different pH conditions (a)—pH=6,合成MnOOH;(b)—pH=12,合成Mn3O4. |
2.2 离子筛及前驱体的表征三种锰源的水热产物XRD分析如图 2所示,可以看出通过水热法制备样品主相与LiMnO2标准图谱(ICDD: 01-072-0411)一致.只是在18.74°,21.18°有杂峰,Highscore软件分析中与Li1.6Mn1.6O4,Li2MnO3匹配度高,说明溶液中锂势充足,在160 ℃下的高压水热釜中,已经出现含锂量更多,且锰价态更高的Li1.6Mn1.6O4,MnOOH和Mn3O4锰源对应的(110)峰更强;但也出现Li2MnO3的杂相.说明若Li+充足,氧化性强,并不会直接合成Li1.6Mn1.6O4[13],过程中会转变出现Li2MnO3杂相.
图 2(Fig. 2)
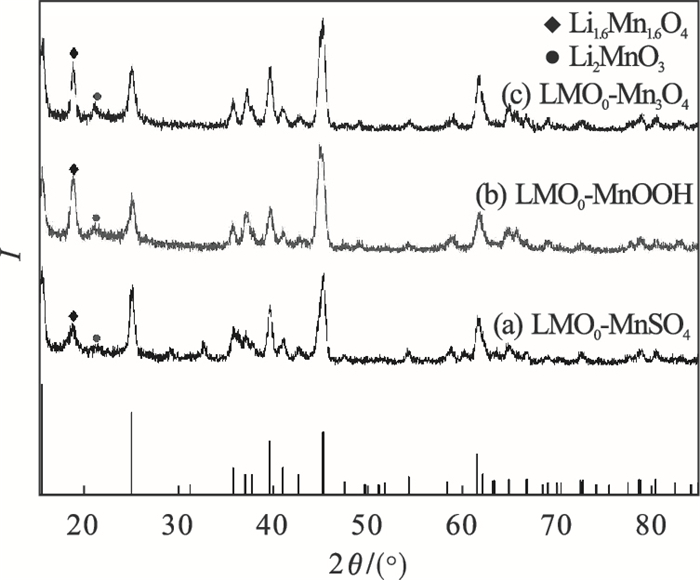 | 图 2 不同锰源合成中间产物o-LiMnO2的XRD图Fig.2 XRD patterns of o-LiMnO2 synthesized from different manganese sources |
三种锂源合成LiMnO2与Li1.6Mn1.6O4反应原理分别如式(4)~(7)所示[13].
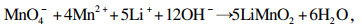 | (4) |
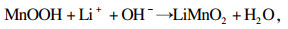 | (5) |
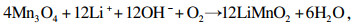 | (6) |
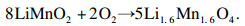 | (7) |
图 3(Fig. 3)
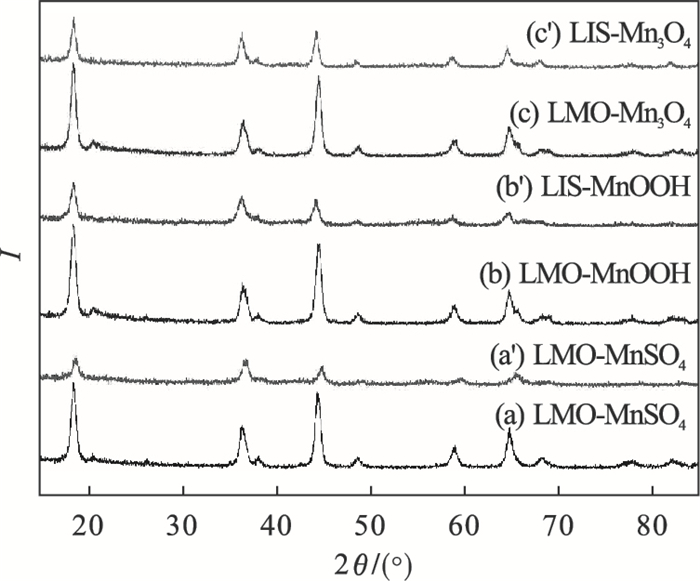 | 图 3 不同锰源合成MnO2·0.5H2O及前驱体的XRD图Fig.3 XRD patterns of MnO2·0.5H2O synthesized from different manganese sources and its precursors |
酸洗实验后,可以看出LMO到LIS的过程中,晶体骨架保持不变,合成的离子筛衍射峰的位置2θ出现整体的右偏移.说明大部分锂脱出且由于酸洗脱附过程中发生Li+与H+的交换,而H+的离子半径小于Li+,导致晶胞收缩,晶面间距变小.
图 4显示了三种锰源LIS的扫描电镜图像.由图可见,三种离子筛显示出纳米团聚现象.观察到LIS-MnSO4(图 4a)及LIS-MnOOH(图 4b)离子筛表现为混合的球状与立方状形态的纳米颗粒,由粒径分布直方图可见,这两种锰源合成的离子筛粒径相差不大,大小约在20~70 nm之间;其中LIS-MnOOH颗粒分布更加均匀,团聚现象更重.LIS-Mn3O4(图 4c)呈现短棒状形貌,直径约30~50 nm,长度约100~200 nm,分散性较前两种更高.
图 4(Fig. 4)
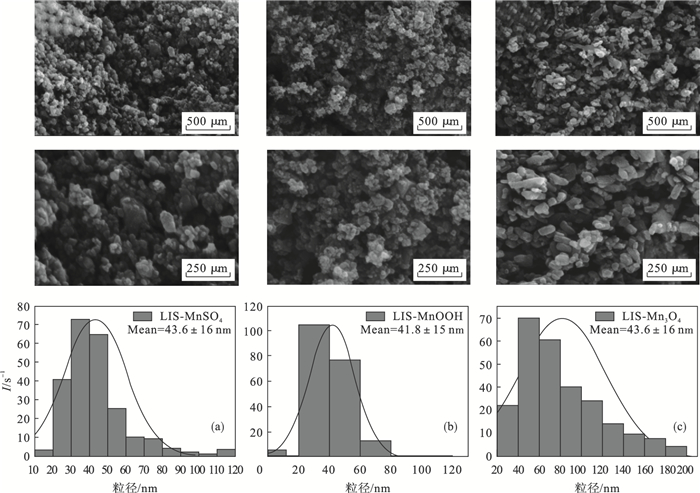 | 图 4 不同锰源合成MnO2·0.5H2O离子筛的SEM图及粒径分布直方图Fig.4 SEM of MnO2·0.5H2O ion sieve synthesized from different manganese sources and determination of their mean particle size (a)—LIS-MnSO4;(b)—LIS-MnOOH;(c)—LIS-Mn3O4. |
对MnSO4源合成的离子筛样品进行能谱分析,结果如图 5所示.表明样品主要含有Mn和O,且锰、氧的原子含量相对比值为1.9.结合XRD图谱可知,离子筛MnO2·0.5H2O中氧锰比为2,也再次证实在形成离子筛过程中,锰氧化合物骨架基本不变,是其中的Li+和盐酸中的H+发生了离子交换反应[14].
图 5(Fig. 5)
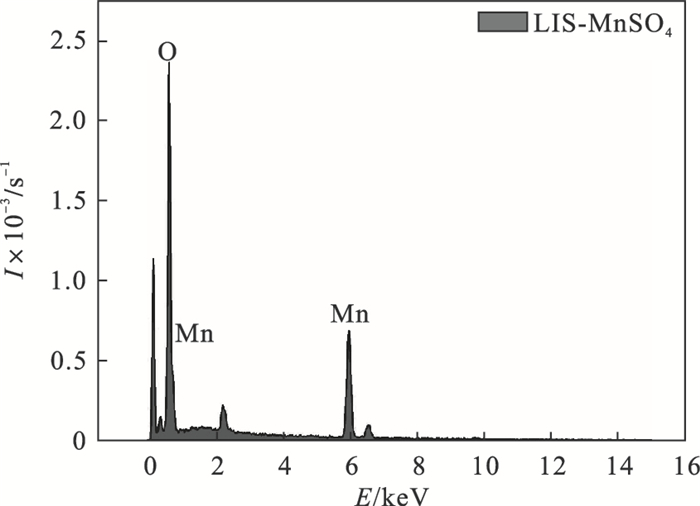 | 图 5 MnSO4源合成离子筛的EDS图Fig.5 EDS diagram of MnSO4 source synthetic ion sieve |
MnOOH和Mn3O4源合成的离子筛样品进行能谱分析,结果如图 6所示.LIS-MnOOH(图 6b)中,出现了少量的C,而LIS-Mn3O4(图 6c)中C含量增多,结合文献[15]红外光谱测试中在1 497和1 433 cm-1出现(CO3)—Li2键,说明在水热及焙烧合成离子筛过程中,空气中的CO2与锂锰氧化物中Li2O基团反应,产生了Li2CO3杂质而被检测出.所以直接由MnSO4一步合成LiMnO2可以一定程度避免样品污染.
图 6(Fig. 6)
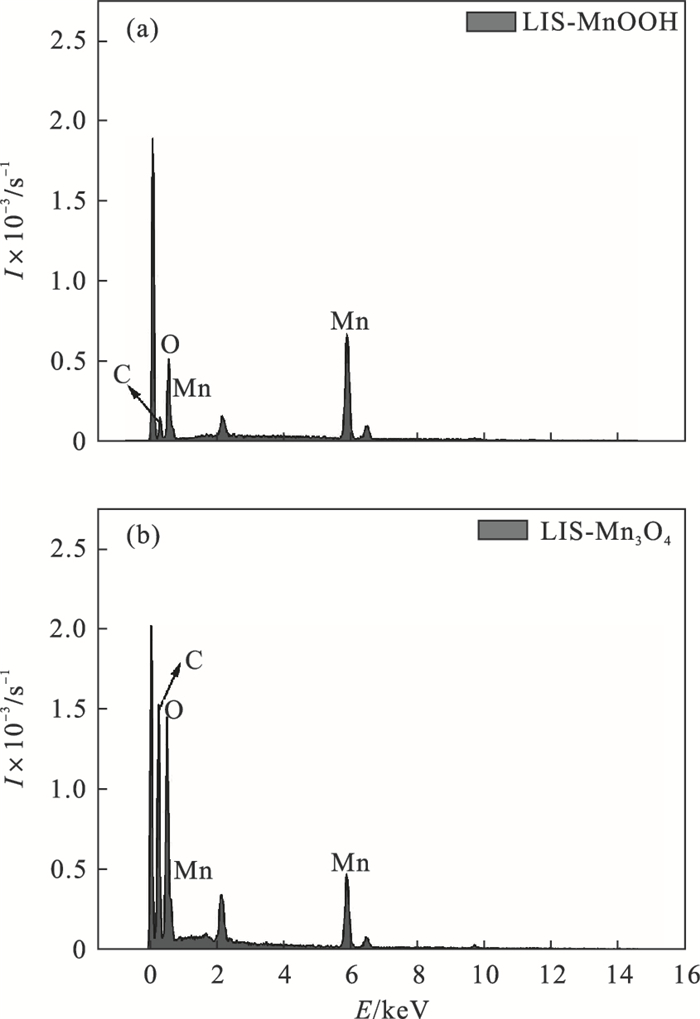 | 图 6 MnOOH和Mn3O4源合成离子筛的EDS图Fig.6 EDS diagram of MnOOH and Mn3O4 source synthetic ion sieve (a)—LIS-MnOOH;(b)—LIS-Mn3O4. |
用N2吸附-解析测试表征了三种离子筛及前驱体的比表面积和孔径分布.由图 7可知,所有离子筛及前驱体的N2吸附-解析等温曲线都显示出具有H3回滞环的Ⅳ型,表明离子筛吸附为表面介孔层吸附.由表 1可见,三种锰源的离子筛前驱体酸洗后比表面积均大幅提升,增量分别为546.6%,129.9%,142.2%,说明酸洗后产生的锂空位增加了离子筛的吸附性能.MnSO4,MnOOH,Mn3O4三种锰源合成的离子筛BET值分别为143.906,62.179,43.563 m2/g,粒径及颗粒分散性不同可能是引起表面积不同的原因之一.Pulido等[15]研究中也发现了随着尺寸增加,表面积减小的现象.
图 7(Fig. 7)
 | 图 7 不同锰源合成LMO和LIS的氮吸附-脱附等温线Fig.7 Nitrogen adsorption-desorption isotherms of LMO and LIS synthesized from different manganese sources |
表 1(Table 1)
| 表 1 不同锰源合成的LMO和LIS结构特性 Table 1 Structural characteristics of LMO and LIS synthesized from different manganese sources |
2.3 吸附实验在30 ℃和pH=12的20 m/L的低锂浓度溶液中,研究了三种离子筛的吸附性能.由图 8可见,锂的吸附能力顺序为LIS-MnSO4(19.5 mg/g)> LIS-MnOOH(9.2 mg/g)>LIS-Mn3O4(3.0 mg/g).
图 8(Fig. 8)
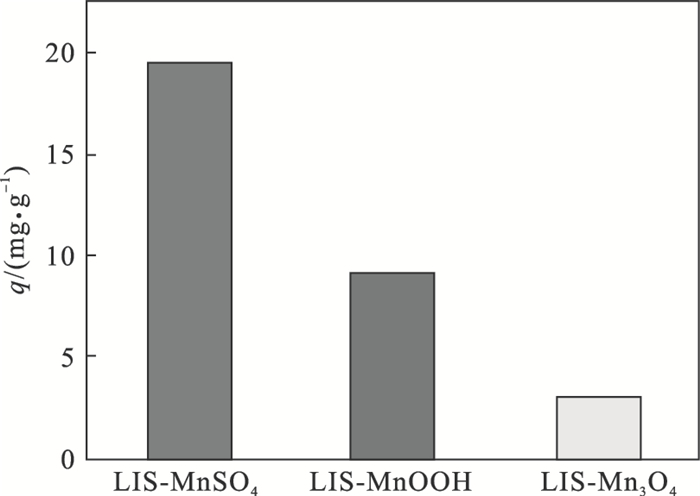 | 图 8 不同锰源合成锂离子筛的吸附图Fig.8 Adsorption diagram of lithium ion sieve synthesized from different manganese sources |
研究表明,环境锂浓度对离子筛提锂能力有较大影响,当在初始锂质量浓度100~929 mg/L的LiCl溶液中提锂,锂离子筛吸附量会由26 mg/g增加至38 mg/g.[3]但实际海水锂质量浓度仅0.17 mg/L,因此探究离子筛在低浓度下性能表现有实际参考价值.
吸附结果说明,以MnSO4一步水热形成的Li1.6Mn1.6O4结构更易与H+交换,这也与XRD的2θ偏移结果对应,说明MnSO4离子筛酸洗后形成的离子筛在结构上有更多的活性位点,而LIS-MnOOH和LIS-Mn3O4中的碳杂质可能对吸附产生了一定阻碍.且γ-MnOOH是(1×1)隧道结构,Mn3O4则是三维尖晶石结构.Yang等[4]证明孔道结构越小,酸性位点越均匀,易脱附,这与本文结论相符.同时结合BET数据可知,LIS-MnSO4的比表面积最大,更有利于活性交换位点的暴露,Li+的吸附更大,所以三种锰源在结构、表面积上的差异一定程度上影响了合成离子筛的吸附性能.
3 结论1) 本文以MnSO4,MnOOH和Mn3O4三种锰源合成了MnO2·0.5H2O离子筛,并对吸附性能进行比较.通过调节溶液pH值,高锰酸钾可将MnSO4分别氧化为MnOOH和Mn3O4.
2) 以MnSO4,MnOOH和Mn3O4三种锰源制备的锂离子筛粒径均较小,在100 nm以下,其中LIS-MnSO4及LIS-MnOOH为球形与立方混合的纳米颗粒,LIS-Mn3O4为纳米棒状形貌,酸洗过程会大幅提升三种离子筛的比表面积.
3) 不同锰源合成的离子筛吸附性能差异大,锰源结构的不同可能造成Li+脱附的差异;LIS-MnSO4离子筛吸附性最好,在20 mg/L的低质量浓度Li+溶液中,吸附量最大达19 mg/g.
参考文献
| [1] | Grosjean C, Miranda P H, Perrin M, et al. Assessment of world lithium resources and consequences of their geographic distribution on the expected development of the electric vehicle industry[J]. Renewable and Sustainable Energy Reviews, 2012, 16(3): 1735-1744. DOI:10.1016/j.rser.2011.11.023 |
| [2] | Xu X, Chen Y, Wan P, et al. Extraction of lithium with functionalized lithium ion-sieves[J]. Progress in Materials Science, 2016, 84: 276-313. DOI:10.1016/j.pmatsci.2016.09.004 |
| [3] | 张志兵. 固相法制备锂离子筛前驱体Li1.6Mn1.6O4及其离子筛吸附性能研究[D]. 长沙: 中南大学, 2012. (Zhang Zhi-bing. Lithium ion-sieve precursor Li1.6Mn1.6O4 by a solid-phase method and adsorption performance of its ion-sieve[D]. Changsha: Central South University, 2012 ) |
| [4] | Yang X, Kanoh H, Tang W, et al. Synthesis of Li1.33Mn1.67O4 spinels with different morphologies and their ion adsorptivities after delithiation[J]. Journal of Materials Chemistry, 2000, 10(8): 1903-1909. DOI:10.1039/b000219o |
| [5] | Chitrakar R, Kanoh H, Miyai Y, et al. A new type of manganese oxide (MnO2·0.5H2O) derived from Li1.6Mn1.6O4 and its lithium ion-sieve properties[J]. Chemistry of Materials, 2000, 12(10): 3151-3157. DOI:10.1021/cm0000191 |
| [6] | Hunter J C. Preparation of a new crystal form of manganese dioxide: λ-MnO2[J]. Journal of Solid State Chemistry, 1981, 39(2): 142-147. DOI:10.1016/0022-4596(81)90323-6 |
| [7] | Sorour M H, Hani H A, El-Sayed M M H, et al. Synthesis, characterization and performance evaluation of lithium manganese oxide for lithium adsorption[J]. Egyptian Journal of Chemistry, 2017, 60(4): 697-710. DOI:10.21608/ejchem.2017.4170 |
| [8] | Li X, Tao B, Jia Q, et al. Preparation and adsorption performance of multi-morphology Li1.6Mn1.6O4 for lithium extraction[J]. Chinese Journal of Chemical Engineering, 2021, 34: 68-76. DOI:10.1016/j.cjche.2020.09.006 |
| [9] | Qian F, Guo M, Qian Z, et al. Highly lithium adsorption capacities of Li1.6Mn1.6O4 ion-sieve by ordered array structure[J]. Chemistry Select, 2019, 4(34): 10157-10163. |
| [10] | Zhang Q H, Sun S, Li S, et al. Adsorption of lithium ions on novel nanocrystal MnO2[J]. Chemical Engineering Science, 2007, 62: 4869-4874. DOI:10.1016/j.ces.2007.01.016 |
| [11] | 马格, 刘凡, 黄丽. 二价锰盐还原KMnO4合成锰矿物及其影响因素研究[J]. 岩石矿物学杂志, 2013, 32(3): 393-400. (Ma Ge, Liu Fan, Huang Li. Study on the reduction of KMnO4 by divalent manganese salts to synthesize manganese minerals and its influencing factors[J]. Journal of Rock Mineralogy, 2013, 32(3): 393-400.) |
| [12] | 宋琳, 姜言霞. 利用手持技术探究酸碱性对高锰酸钾氧化性的影响[J]. 化学教育(中英文), 2020, 41(19): 103-106. (Song Lin, Jiang Yan-xia. Using hand-held technology to explore the effect of acidity and alkalinity on the oxidation of potassium permanganate[J]. Chemistry Education (Chinese and English), 2020, 41(19): 103-106.) |
| [13] | Xiao J L, Sun S Y, Wang J, et al. Synthesis and adsorption properties of Li1.6Mn1.6O4 spinel[J]. Industrial & Engineering Chemistry Research, 2013, 52(34): 11967-11973. |
| [14] | Clearfield A. Inorganic ion exchangers, past, present, and future[J]. Solvent Extraction and Ion Exchange, 2000, 18(4): 655-678. DOI:10.1080/07366290008934702 |
| [15] | Pulido R, Naveas N, Graber T, et al. Hydrothermal control of the lithium-rich Li2MnO3 phase in lithium manganese oxide nanocomposites and their application as precursors for lithium adsorbents[J]. Dalton Transactions, 2021, 50(31): 10765-10778. DOI:10.1039/D1DT01638E |