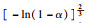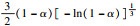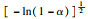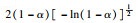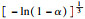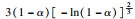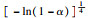1. 东北大学 冶金学院,辽宁 沈阳 110819;
2. 营口理工学院 材料学院,辽宁 营口 115014
收稿日期:2022-07-28
基金项目:国家自然科学基金资助项目(21878045)。
作者简介:郭丽莉(1989-),女,辽宁营口人,东北大学博士研究生;
涂赣峰(1964-),男,江西萍乡人,东北大学教授,博士生导师;
冯乃祥(1944-),男,河北唐山人,东北大学教授,博士生导师。
摘要:采用隔膜电解法以盐湖水氯镁石为原料制备前驱体Mg(OH)2,煅烧后制备纳米氧化镁,实现盐湖废弃资源的高值化利用.对Mg(OH)2煅烧过程进行热解动力学解析,结合热解机理和速率,考察煅烧条件对MgO性能的影响.结果表明:煅烧温度升高,MgO的比表面积降低,活性先升高后降低,晶粒变大;煅烧时间延长,MgO的比表面积和活性降低,晶粒尺寸增大,结构变得致密;升温速率增大,MgO比表面积与活性均先增大后平缓,晶粒尺寸基本不变;MgO比表面积最大为29.3 m2/g,CAA最小为66 s,晶粒尺寸最小为27.8 nm.
关键词:氢氧化镁煅烧反应动力学纳米氧化镁活性
Preparation of Nano-sized MgO Using Electrolytic Mg(OH)2
GUO Li-li1, TU Gan-feng1, FENG Nai-xiang1, DI Yue-zhong1


1. School of Metallurgy, Northeastern University, Shenyang 110819, China;
2. School of Materials, Yingkou Institute of Technology, Yingkou 115014, China
Corresponding author: DI Yue-zhong, E-mail: diyz@smm.neu.edu.cn.
Abstract: The precursor of Mg(OH)2 was prepared by diaphragm electrolysis with bischofite in salt lake, and then calcined to obtain nano-sized MgO, so as to realize the high-quality utilization of waste resources. The pyrolysis kinetics of the calcination process of Mg(OH)2 was analyzed and the effects of calcination conditions on the MgO properties were investigated, combined with the pyrolysis mechanism and rate. The results show that with increasing calcination temperature, the specific surface area of MgO decreases, the activity firstly increases and then decreases, and the grain size increases. When the calcination time increases, the specific surface area and activity of MgO decreases, the grain size increases, and the structure becomes denser. Furthermore, with the increase of heating rate, the specific surface area and activity of MgO firstly increases and then becomes stable, and the grain size mainly remains unchanged. The maximum specific surface area of MgO is 29.3 m2/g, the minimum CAA is 66 s, and the minimum grain size is 27.8 nm.
Key words: magnesium hydroxide (Mg(OH)2)calcinationreaction kineticsnano-sized magnesium oxide (MgO)activity
氧化镁是一种重要的无机化工材料,具有良好的化学活性、分散性、耐磨性、耐腐蚀性等,被广泛应用于耐火材料、陶瓷、医药、食品、化妆品、油漆、涂料、催化、吸波材料、传感材料等领域[1-3].目前,制备氧化镁的主要方法有固相法、溶胶-凝胶法、水热法及前驱体法等,原料来源主要为菱镁矿和盐湖卤水[4-6].
随着高性能氧化镁粉体的需求越来越大,其应用前景极好,广受科研工作者关注.目前对于高性能氧化镁的研究主要集中在氧化镁的活性、粒度和形貌等方面.Wang等[7]以乙酸为改性剂,通过化学共沉淀法制备了钛掺杂的纳米氧化镁材料,证明乙酸可以显著减小粒径,改善纳米颗粒的粒径分布和分散性;Alavi等[8]以乙酸镁与氢氧化钠为原料,采用超声化学反应法合成了氢氧化镁纳米结构,并在400 ℃煅烧制备了氧化镁纳米颗粒;Ren等[9]以饱和氯化镁为原料,采用高温喷雾热分解法制备高活性氧化镁前驱体,并在不同温度下煅烧,制备出高活性纳米氧化镁薄球状材料,直径为30~100 nm,BET比表面积最大值达到31.6 m2/g.
青海盐湖拥有我国储量最大的镁盐资源,但是长期以来,采钾过程中排除的大量含镁废卤水未得到有效利用,在青海特殊地理环境下形成巨量的水氯镁石,甚至造成盐湖成分变化而成“镁害”,不仅浪费了大量优势资源,而且造成了极大的环境压力[10].本研究以青海盐湖水氯镁石(MgCl2·6H2O)为原料,采用隔膜电解法[11-13]制备前驱体氢氧化镁,再经过煅烧制备纳米氧化镁粉体,考察煅烧工艺条件对产物纳米氧化镁活性的影响,实现了废弃资源的综合利用,探索出一条高性能氧化镁制备工艺流程,为后续氧化镁粉体应用提供基础数据和科学依据.
1 实验电解实验原料为青海盐湖水氯镁石;其他试剂为无水乙醇、柠檬酸、酚酞,均为分析纯.
电解实验设备为自制有机玻璃电解槽(容量为2 L,阳极为表面覆盖RuO2和TiO2的钛板,阴极为钛板,阴极槽与阳极槽之间由一层聚四氟乙烯膜隔开,电极板面积为100 cm2);煅烧实验采用SX-G80123气氛保护电阻炉;XRD分析采用德国布鲁克公司生产的D8 advance X射线衍射仪;SEM分析采用日本日立公司生产的S4800场发射扫描电子显微镜;差热分析采用美国TA公司生产的SDT-Q600差示扫描量热-热重分析仪;比表面积测试(BET)采用贝士德公司的3H-2000PS1表面积分析仪.
氧化镁活性检测采用柠檬酸法[14].称取14.71 g柠檬酸,用1 000 mL容量瓶配置柠檬酸标准溶液.取200 mL柠檬酸溶液置于34 ℃磁力搅拌器上,取1.7 g煅烧产物氧化镁置于300 mL烧杯中并加入转子,在柠檬酸溶液中加入4滴酚酞作为指示剂,将已恒温的柠檬酸溶液迅速倒入盛有氧化镁的烧杯中,同时打开秒表,开动磁力搅拌器(600 r/min),待溶液呈红色后停表,以秒数表示氧化镁的活性(CAA),变色时间越短,表示氧化镁的活性越高.
2 结果与讨论2.1 氢氧化镁的制备与表征以水氯镁石为原料,采用隔膜电解法,在电解质(MgCl2·6H2O)浓度0.3 mol/L,电解温度30 ℃,电流密度300 A/m2,极距4 cm条件下电解得到Mg(OH)2沉淀,主要电极反应:阳极,2Cl--2e=Cl2↑;阴极,Mg2++2OH-=Mg(OH)2↓,2H2O+2e=2OH-+H2↑.将沉淀过滤烘干后得到前驱体Mg(OH)2粉体,经XRD和SEM分析(见图 1,图 2),产物为片状,粒径较小、厚度薄,结晶度良好且衍射峰与氢氧化镁标准卡相吻合.
图 1(Fig. 1)
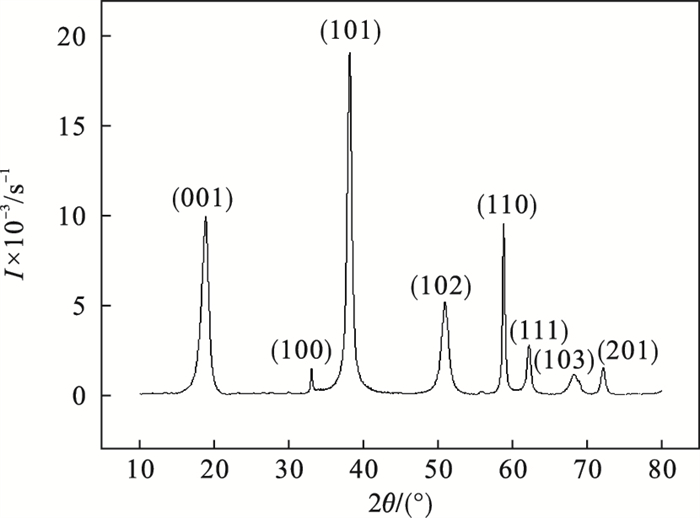 | 图 1 氢氧化镁粉体的XRD图Fig.1 XRD pattern for Mg(OH)2 powders |
图 2(Fig. 2)
 | 图 2 氢氧化镁粉体的SEM图Fig.2 SEM image of Mg(OH)2 powders |
在N2气氛下对前驱体Mg(OH)2粉体进行热重分析,升温速率分别为5,10,15和20 ℃/min,升温范围为室温至800 ℃,得到不同升温速率下氢氧化镁TG-DTG曲线(见图 3).由图 3可知,氢氧化镁样品分解反应主要发生在280~360 ℃之间,且随着升温速率不同,转化率曲线逐渐向右偏移,说明升温速率越快,达到相同转化率所需温度越高.由于氢氧化镁的热解动力学参数和热解机理受原料来源的影响,因此对实验制备的氢氧化镁粉体进行动力学分析,以此为理论参考探索制备氧化镁的最佳工艺条件.
图 3(Fig. 3)
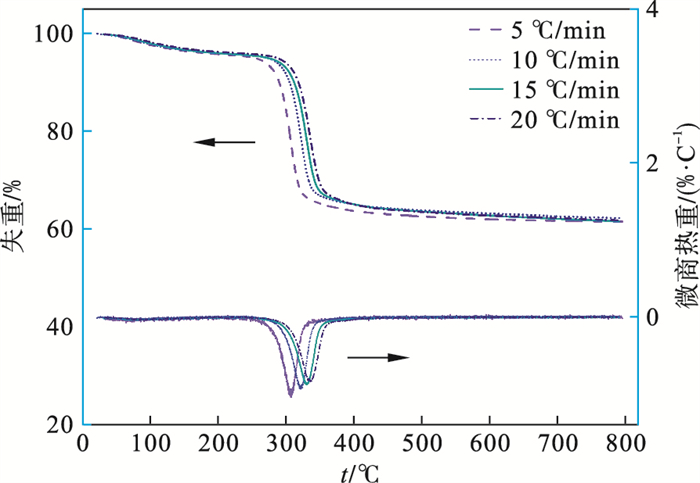 | 图 3 不同升温速率下氢氧化镁TG-DTG曲线Fig.3 TG-DTG curves of Mg(OH)2 at different heating rate |
2.2 热分解动力学解析本文采用微分法中的Friedman法计算氢氧化镁的热解表观活化能Ea和指前因子A,采用积分法中的Vyazovkin法进行验证,最后进行热分解机理分析[15].
首先采用Friedman法,利用图 3中的TG曲线得出氢氧化镁在不同升温速率下转化率α分别为0.20,0.25,0.30,0.35,…,0.80时的温度T,根据式(1)以ln[β(dα/dT)]对1/T作图(图 4),由拟合直线斜率Ea/R计算表观活化能Ea为121.68 kJ·mol-1,根据拟合直线的截距求得指前因子A为3.378×1010 min-1.
 | (1) |
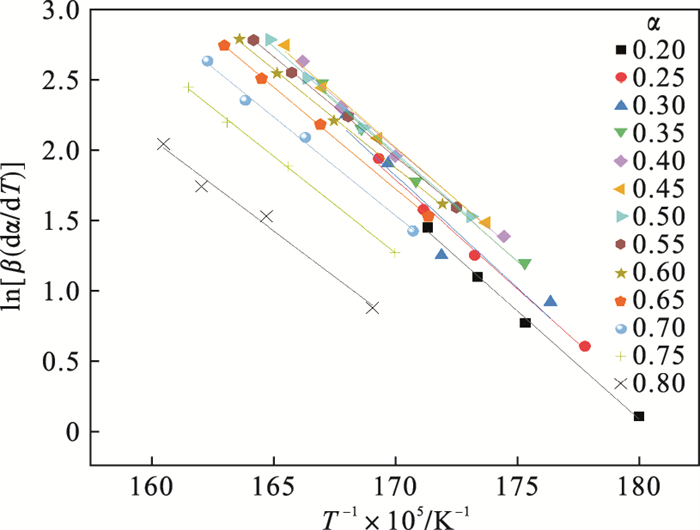 | 图 4 ln[β(dα/dT)]与1/T的线性拟合曲线Fig.4 Linear fitting curves of ln[β(dα/dT)]and 1/T |
Vyazovkin法的动力学方程如式(2)所示:
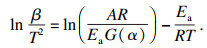 | (2) |
图 5(Fig. 5)
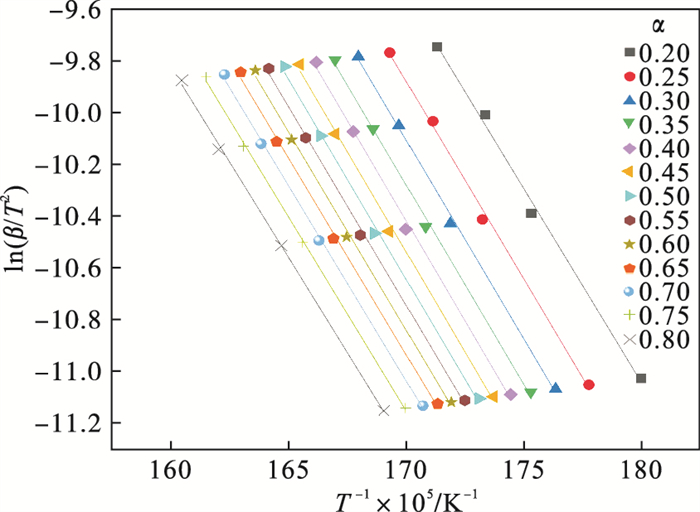 | 图 5 ln(β/T2)与1/T的线性拟合曲线Fig.5 Linear fitting curves of ln(β/T2) and 1/T |
Bagchi等[16]提出用微分法和积分法相结合的方法对非等温动力学数据进行处理以确定反应机理,Criado等[17]提出可用以下方程确定反应机理函数:
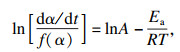 | (3) |
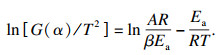 | (4) |
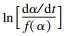
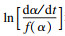
表 1(Table 1)
| 表 1 常见的随机成核和随后生长反应的动力学参数 Table 1 Kinetic parameters of the common random nucleation and subsequent growth reaction |
表 2(Table 2)
| 表 2 积分法和微分法得出的各机理函数的动力学参数 Table 2 Kinetic parameters of each mechanism function calculated by integral and differential methods | ||||||||||||||||||||||||||||||||||||||||||||||||||
由前文Friedman法和Vyazovkin法获得的氢氧化镁的热分解表观活化能分别为121.68 kJ·mol-1和127.10 kJ·mol-1,指前因子为3.378×1010 min-1,可以看出与A1.5机理函数计算值最为接近,因此氢氧化镁热分解的机理函数为A1.5,其热分解反应的机理遵循形核与长大模型(n=1.5),其机理函数积分式为G(α)=[-ln(1-α)]2/3,微分式为f(α)=3/2(1-α)[-ln(1-α)]1/3.
2.3 煅烧工艺对氧化镁活性的影响本节以隔膜电解法制备的Mg(OH)2粉体为原料,结合热分解机理和速率,在空气中采用电阻炉煅烧,考察煅烧温度、煅烧时间、升温速率等不同工艺对煅烧产物氧化镁活性、晶粒尺寸和形貌的影响,为后续氧化镁陶瓷的制备寻找最优原料.
2.3.1 煅烧温度对氧化镁活性的影响采用单因素实验,考察煅烧温度对氧化镁活性的影响.以5 ℃/min的升温速率,在不同温度下对氢氧化镁进行煅烧,保温时间2 h,煅烧温度分别取350,400,500,600,700,800 ℃,煅烧产物氧化镁各项性能如图 6和图 7所示.
图 6(Fig. 6)
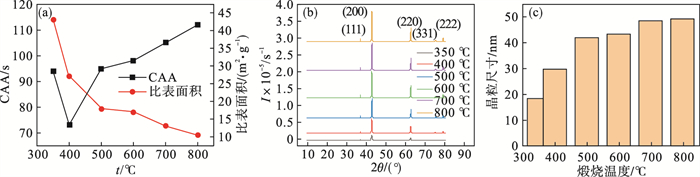 | 图 6 煅烧温度对氧化镁性能的影响Fig.6 Effect of calcination temperature on the MgO properties (a)—活性及比表面积;(b)—XRD图;(c)—晶粒尺寸. |
图 7(Fig. 7)
 | 图 7 不同煅烧温度下氧化镁SEM图Fig.7 SEM images for MgO at different calcination temperature (a)—350 ℃;(b)—400 ℃;(c)—500 ℃;(d)—600 ℃;(e)—700 ℃;(f)—800 ℃. |
图 6a是煅烧温度对氧化镁的CAA和比表面积影响曲线,由图可以看出,随着煅烧温度的升高,氧化镁的比表面积不断降低,而CAA先降低后升高,在400 ℃时CAA达到最低73 s,说明煅烧后的氧化镁活性先升高后降低,在400 ℃时活性最高.当煅烧温度为350 ℃时,前驱体氢氧化镁没有完全分解,晶粒结构有较大缺陷,氧化镁活性较低,此时比表面积较大是由于氢氧化镁本身具有较大比表面积;在煅烧温度为400 ℃时,前驱体氢氧化镁分解趋于完全,晶体的结晶度好,晶粒细小,晶粒间细微空隙较多,活性最好,比表面积较大;随着煅烧温度继续升高,氧化镁晶粒不断长大,部分氧化镁出现过烧现象,活性降低,比表面积降低.
图 6b和6c分别是不同煅烧温度下氧化镁的XRD曲线和谢乐公式计算的晶粒尺寸,由图 6b可以看出,在350 ℃时,有氢氧化镁的衍射峰存在,进一步说明此时氢氧化镁未完全分解,随着煅烧温度升高,衍射峰变得窄且尖锐,衍射强度大,说明晶体发育良好,晶粒尺寸不断增大,结晶度高.图 6c也可以证明,随着煅烧温度升高,晶粒尺寸由18.4 nm增大到49.2 nm,说明煅烧得到的粉体为纳米氧化镁.
图 7是不同煅烧温度下氧化镁的SEM图,图 7a中煅烧温度较低,晶粒较小且团聚现象明显.由图 7b看出,在400 ℃时,晶粒逐渐生长且仍有较明显团聚,大部分晶体粒径小于100 nm,符合纳米氧化镁标准.图 7c、图 7d和图 7e中,晶粒团聚现象减弱,晶粒逐渐长大且趋于规则,图 7e和图 7f对比看出,在700 ℃以上,晶粒大小趋于稳定,晶粒形貌趋于完整的六边形结构.
2.3.2 煅烧时间对氧化镁活性的影响采用单因素实验,考察煅烧时间对氧化镁活性的影响.以5 ℃/min的升温速率,在400 ℃下对氢氧化镁进行煅烧,保温时间分别取1,2,3,4,5 h,煅烧产物氧化镁各项性能如图 8和图 9所示.
图 8(Fig. 8)
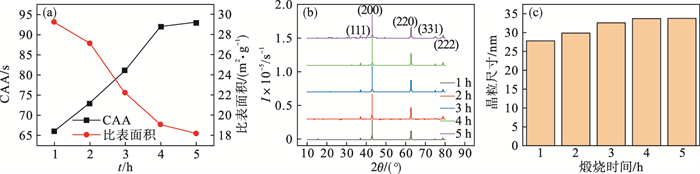 | 图 8 煅烧时间对氧化镁性能的影响Fig.8 Effect of calcination time on the MgO properties (a)—活性及比表面积;(b)—XRD图;(c)—晶粒尺寸. |
图 9(Fig. 9)
 | 图 9 不同煅烧时间下氧化镁SEM图Fig.9 SEM images for MgO at different calcination times (a)—1h;(b)—2h;(c)—3h;(d)—4h;(e)—5h. |
图 8a是煅烧时间对氧化镁CAA和比表面积影响曲线,由图可以看出,随着煅烧时间的延长,氧化镁的比表面积不断降低,CAA不断升高,在1 h时比表面积达到最大29.3 m2/g,CAA值达到最低66 s,说明随着煅烧时间延长,氧化镁结晶度逐渐增大,活性降低,当煅烧时间达到4 h,氧化镁晶体生长较为完整,比表面积和活性趋于稳定.
图 8b和8c分别是不同煅烧温度下氧化镁的XRD曲线和谢乐公式计算的晶粒尺寸,由图 8b可以看出,煅烧时间少于4 h时,随着煅烧时间的增加,衍射峰变得窄且尖锐,说明晶体发育良好,晶粒尺寸不断增大,煅烧时间为4 h和5 h时,变化不太明显,说明此时晶粒发育完整,不再变化.图 8c也可以证明,随着煅烧时间由1 h变化到4 h,晶粒尺寸由27.8 nm增大到33.8 nm,煅烧时间大于4 h,晶粒尺寸不变,煅烧产物仍为纳米氧化镁.
氧化镁的活性由两种因素共同控制,一是煅烧反应开始阶段前驱体氢氧化镁分解产生的H2O在向外扩散时形成大量孔洞,二是随着氧化镁的生长,使形成的孔洞消失.在前驱体刚分解完全时,氧化镁晶粒较小,H2O扩散形成的孔洞还未消失,此时氧化镁的活性最高;随着煅烧时间延长,氧化镁晶体不断生长,结构趋于致密,氧化镁的活性降低.图 9是不同煅烧时间下氧化镁的SEM图,可见随着煅烧时间的延长,氧化镁结构趋于致密,因此活性降低.
2.3.3 升温速率对氧化镁活性的影响采用单因素实验,考察升温速率对氧化镁活性的影响.以不同升温速率,在400 ℃下对氢氧化镁煅烧2 h,升温速率分别取1,5,10,15 ℃/min,煅烧产物氧化镁各项性能如图 10和图 11所示.
图 10(Fig. 10)
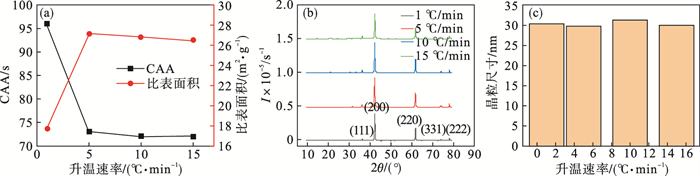 | 图 10 升温速率对氧化镁性能的影响Fig.10 Effect of heating rate on the MgO properties (a)—活性及比表面积;(b)—XRD图;(c)—晶粒尺寸. |
图 11(Fig. 11)
 | 图 11 不同升温速率下氧化镁SEM图Fig.11 SEM images for MgO at different heating rates (a)—1 ℃/min;(b)—5 ℃/min;(c)—10 ℃/min;(d)—15 ℃/min. |
图 10a是升温速率对氧化镁CAA和比表面积影响曲线,由图可以看出,随着升温速率的增大,氧化镁的比表面积先增大后平缓,CAA先降低后平缓,在升温速率为1 ℃/min时,热量能够均匀地传递到前驱体内部,使得分解反应完全,氧化镁晶粒得到充分生长,因此比表面积较小,活性较低;升温速率大于5 ℃/min后,氧化镁的比表面积和活性几乎保持不变,说明此时升温速率对氧化镁活性的影响较小.
图 10b和10c分别是不同升温速率下氧化镁的XRD曲线和谢乐公式计算的晶粒尺寸,由两图可以看出,不同升温速率下氧化镁衍射峰高度基本一致,晶粒尺寸在29.8 nm到31.3 nm之间,基本保持不变,仍为纳米氧化镁.
图 11是不同升温速率下氧化镁的SEM图,可见氧化镁团聚现象较为明显,在10 ℃/min时,氧化镁晶粒较为均匀.
3 结论1) 隔膜电解法制备出片状氢氧化镁,其热解活化能为121.68 kJ·mol-1,指前因子为3.378×1010 min-1,热解机理函数为A1.5,遵循形核与长大模型(n=1.5),其机理函数积分式为G(α)=[-ln(1-α)]2/3,微分式为f(α)=3/2(1-α)[-ln(1-α)]1/3.
2) 随着煅烧温度的升高,氧化镁的比表面积不断减少,活性先升高后降低,晶粒不断变大,氢氧化镁分解完全;随着煅烧时间的延长,氧化镁的比表面积和活性降低,晶粒尺寸增大,结构变得致密;随着升温速率的增大,氧化镁比表面积和活性先增大后平缓,晶粒尺寸基本保持不变;在煅烧温度400 ℃,煅烧时间1 h时,升温速率5 ℃/min时,产物氧化镁比表面积最大为29.3 m2/g,CAA最小为66 s,晶粒尺寸最小为27.8 nm.
3) 隔膜电解法制备的片状氢氧化镁煅烧能够得到纳米氧化镁,纳米氧化镁的比表面积、活性和晶粒尺寸等性能受煅烧温度影响最大,煅烧时间影响次之,受升温速率影响较小.
参考文献
| [1] | Bedair T M, Heo Y, Ryu J, et al. Biocompatible and functional inorganic magnesium ceramic particles for biomedical applications[J]. Biomaterials Science, 2021, 9(6): 1903-1923. DOI:10.1039/D0BM01934H |
| [2] | Karthik K, Dhanuskodi S, Gobinath C, et al. Fabrication of MgO nanostructures and its efficient photocatalytic, antibacterial and anticancer performance[J]. Journal of Photochemistry and Photobiology B: Biology, 2019, 190: 8-20. DOI:10.1016/j.jphotobiol.2018.11.001 |
| [3] | Jiang N, Xie R J, Liu Q, et al. Fabrication of sub-micrometer MgO transparent ceramics by spark plasma sintering[J]. Journal of the European Ceramic Society, 2017, 37(15): 4947-4953. DOI:10.1016/j.jeurceramsoc.2017.06.021 |
| [4] | Liu S S, Wei X H, Lin S, et al. Preparation of aerogel Mg(OH)2 nanosheets by a combined sol-gel-hydrothermal process and its calcined MgO towards enhanced degradation of paraoxon pollutants[J]. Journal of Sol-Gel Science and Technology, 2021, 99(1): 122-131. DOI:10.1007/s10971-021-05561-7 |
| [5] | Chai S J, Luo B J, Wu H H, et al. Controlled synthesis of Mg(OH)2 nanorods using basic magnesium chloride as precursor[J]. Molecular Crystals and Liquid Crystals, 2021, 724(1): 90-101. DOI:10.1080/15421406.2021.1907039 |
| [6] | Li G, Li Z H, Ma H W, et al. Preparation of magnesia nanoballs from dolomite[J]. Integrated Ferroelectrics, 2013, 145: 170-177. DOI:10.1080/10584587.2013.789301 |
| [7] | Wang W, Qiao X L, Chen J G, et al. Preparation and characterization of Ti-doped MgO nanopowders by a modified coprecipitation method[J]. Journal of Alloys and Compounds, 2008, 461: 542-546. DOI:10.1016/j.jallcom.2007.07.046 |
| [8] | Alavi M A, Morsali A. Syntheses and characterization of Mg(OH)2 and MgO nanostructures by ultrasonic method[J]. Ultrasonics Sonochemistry, 2010, 17: 441-446. DOI:10.1016/j.ultsonch.2009.08.013 |
| [9] | Ren X F, Zhou Y, Sun Q G. Investigation and preparation of high active nano-MgO thin spherical material[J]. Integrated Ferroelectrics, 2012, 138(1): 128-136. DOI:10.1080/10584587.2012.688654 |
| [10] | Wu C Y, Chen C, Zhang H F, et al. Preparation of magnesium oxysulfate cement using magnesium-rich byproducts from the production of lithium carbonate from salt lakes[J]. Construction and Building Materials, 2018, 172: 597-607. DOI:10.1016/j.conbuildmat.2018.04.005 |
| [11] | Kang J, Keikhaei M, Li T, et al. Galvanostatic electrochemical deposition of Cu-doped Mg(OH)2 thin films and fabrication of p-n homojunction[J]. Materials Research Bulletin, 2021, 137: 111207. DOI:10.1016/j.materresbull.2021.111207 |
| [12] | 狄跃忠, 马广超, 沈自强, 等. SO42-对电沉积法制备氢氧化镁的影响[J]. 东北大学学报(自然科学版), 2020, 41(10): 1415-1420. (Di Yue-zhong, Ma Guang-chao, Shen Zi-qiang, et al. Effect of SO42- on preparation of magnesium hydroxide by electrode position[J]. Journal of Northeastern University (Natural Science), 2020, 41(10): 1415-1420. DOI:10.12068/j.issn.1005-3026.2020.10.008) |
| [13] | Pan X J, Dou Z H, Meng D L, et al. Electrochemical separation of magnesium from solutions of magnesium and lithium chloride[J]. Hydrometallurgy, 2020, 191: 105166. DOI:10.1016/j.hydromet.2019.105166 |
| [14] | 汪衢, 白丽梅, 马玉新, 等. 菱镁矿煅烧制备氧化镁及其活性检测的研究进展[J]. 有色金属(冶炼部分), 2022(1): 36-44. (Wang Qu, Bai Li-mei, Ma Yu-xin, et al. Research progress on preparation of magnesia by calcination of magnesite and its activity detection[J]. Nonferrous Metals(Extractive Metallurgy), 2022(1): 36-44.) |
| [15] | Yue L H, Jin D L, Lu D Y, et al. The non-isothermal kinetic analysis of thermal decomposition of Mg(OH)2[J]. Acta Physico-Chimica Sinica, 2005, 21(7): 752-757. DOI:10.3866/PKU.WHXB20050711 |
| [16] | Bagchi T P, Sen P K. Kinetics of densification of powder compacts during the initial stage of sintering with constant rates of heating.A thermal analysis approach(Ⅱ): haematite compacts[J]. Thermochimica Acta, 1982, 56(3): 269-283. DOI:10.1016/0040-6031(82)87035-4 |
| [17] | Criado J M, Ortega A. Clarification of some kinetic concepts in solid state reactions[J]. Thermochimica Acta, 1994, 239: 1-6. DOI:10.1016/0040-6031(94)87050-0 |