
 , 王学涛3, 王志强1,2
, 王学涛3, 王志强1,2 1. 山东大学 能源与动力工程学院,山东 济南 250061;
2. 燃烧污染物减排国家工程实验室,山东 济南 250061;
3. 河南科技大学 车辆与交通工程学院,河南 洛阳 471003
收稿日期:2021-12-13
基金项目:国家自然科学基金资助项目(51776113);山东省重点研发计划项目(2020CXGC011402);山东省自然科学基金资助项目(ZR2020ME190)。
作者简介:张艺腾(1996-),男,山西长治人,山东大学硕士研究生;
程星星(1984-),女,江苏徐州人,山东大学教授,博士生导师;
王志强(1978-),男,山东济南人,山东大学教授,博士生导师;
王学涛(1976-),男,河南孟津人,河南科技大学教授,博士生导师。
摘要:以废弃生物质制备生物炭进行高值利用为目标,以废弃白菜叶(waste cabbage leave, WCL)为原料,在系列热解温度(420, 520, 620, 720 ℃)下制备生物炭,利用傅里叶红外光谱仪、X射线衍射等手段对生物炭进行表征,考察热解气体与生物炭性质之间的关系.结果表明:生物质的能量回收要聚焦工艺条件,与热解气、升温速率等条件相关,而生物炭的生产则与热解终温和保持时间等相关.不同的热解气体与生物炭表面官能团变化、微观碳结构可以建立对应关系.低温生物炭表面官能团丰度较高,含氧官能团丰度可以达到55%,高温生物炭结构更有序;此外,520 ℃可能是WCL的生物热解特征温度点.
关键词:生物炭废弃蔬菜叶TG-FTIR等温热解表面官能团
Biochar Properties of Waste Vegetable Leaves by Isothermal Pyrolysis
ZHANG Yi-teng1,2, CHENG Xing-xing1,2

 , WANG Xue-tao3, WANG Zhi-qiang1,2
, WANG Xue-tao3, WANG Zhi-qiang1,2 1. School of Energy and Power Engineering, Shandong University, Jinan 250061, China;
2. National Engineering Laboratory for Reducing Emissions from Coal Combustion, Jinan 250061, China;
3. School of College of Vehicle and Traffic Engineering, Henan University of Science and Technology, Luoyang 471003, China
Corresponding author: CHENG Xing-xing, E-mail: xcheng@sdu.edu.cn.
Abstract: The waste cabbage leave(WCL)was used as raw material to prepare biochars under various temperatures(420, 520, 620, 720 ℃). Biochars were comprehensively characterized by Fourier transform infrared spectroscopy(FTIR), X-ray diffraction(XRD)and so on. Additionally, the relationship between pyrolysis gas and biochar properties was investigated. The results show that biomass energy recovery could concentrate on the process conditions, as pyrolysis gas is significantly correlated with the heating rate, while biochar production is influenced by the heat and retention time at the end of pyrolysis. Pyrolytic gases could be correlated with the changes of functional groups on biochar surface and the microstructure of carbon. High-temperature biochars have more ordered structures, but low-temperature biochars have more functional groups and their oxygen-containing functional groups can reach 55%. In addition, 520 ℃ may be the characteristic temperature point of bio-pyrolysis of WCL.
Key words: biocharwaste cabbage leaveTG-FTIRisothermal pyrolysissurface functional group
当前,化石燃料的快速消耗已经导致了严重的环境问题(如酸雨、冰川消融、空气质量下降等).这要求人类在能源利用上要发生重大转变[1].生物质具有低硫、低氮、零二氧化碳净排放的特点,显示出其作为能源生产替代燃料的巨大潜力,但是也存在能量密度低、热值低、储运不便等问题,直接应用难度大[2].生物化学转化(发酵、堆肥等)、热化学转化(燃烧、热解等)和生物高值化材料转化(生物柴油、生物乙醇等)是常见的废弃生物质处理技术[3].但是,生物化学利用存在着占地面积大、工程周期长等不利因素.生物高值化材料转化效果不稳定.热化学方法可以将废弃生物质转化为高附加值的产品受到越来越多研究者的青睐.热裂解过程伴随着质量损失,以及热解液、生物炭和热解气的生成,可以实现对生物质能的合理回收[4].
废弃蔬菜叶(waste cabbage leave, WCL)是种类复杂、成分多样的有机固体废弃物,也是一种典型的生物质资源.在整个蔬菜收割、运输、市场销售的过程中会出现8%的蔬菜垃圾,即加工865.8万吨蔬菜的过程中最少产生70.2万吨蔬菜垃圾[5].如果处理不当,则会产生环境(如土壤和地下水污染、温室气体产生等)和公众健康问题(如蚊虫滋生、病菌繁殖等);如果处理得当,则可以发挥其转变为能源的潜力,得到高附加值的产品[6].在之前的研究中,已经指出WCL具有高挥发分、低固定碳、低灰分、低硫等特点,其纤维素质量分数约占37%,这些特点对其热化学转化应用是有利的[6].通过控制热解条件生产生物炭已成为利用废弃生物质的途径之一[7].
生物炭在固体燃料、固碳、土壤修复、活性炭前驱体、冶金工业还原剂、废水处理吸附材料等方面扮演着重要的角色[7],其性质受原料类型、热解温度、升温速率等工艺条件的影响[8].在生物炭形成过程中,水分、挥发物和大部分非碳元素(氧、氢、氮、硫)被去除,大分子(主要是纤维素、半纤维素和木质素)在不同的温度和升温速率下分解[9].生物炭的性能往往与表面官能团和微晶结构相关[10].TG-FTIR联用可以在宏观上实时监测热解过程中的质量损失和气体演变,用来估计蔬菜残渣提取物、油菜渣等废弃生物质的热解特性,进而应用于生物炭的性质预测[11].X射线衍射技术(XRD)、傅里叶变换红外光谱技术(FTIR)和拉曼技术(Raman)被广泛应用于表征煤、生物炭等化学结构[12].
目前,关于废弃生物质热解行为已经有一些研究成果,但针对WCL的等温热解成焦过程的研究有限,而探究热解气体与生物炭理化性质之间规律的研究也有限.因此,本文研究了不同热解温度下生物炭的化学结构变化,采用热重分析仪(TGA)结合傅里叶红外气体分析(FTIR)在等温条件(420,520,620,720 ℃)下对WCL进行热解等温成焦实验,提出从热解气体演化规律的角度来推测生物炭的理化性质,同时将对不同热解温度下(370~820 ℃)制备的WCL生物炭理化性质进行分析,希望可以为WCL的广泛应用提供全面的科学理论和技术参考.
1 实验材料和方法1.1 原料及生物炭材料制备本文以WCL为原料,清洗、材料成块,方便后期操作.实验前将样品在干燥箱干燥24 h,之后在冷冻干燥机干燥24 h.将干燥后的样品放置于干燥皿中备用.图 1是回收WCL生物炭所用工作台,样品在升温速率为10 ℃/min,流量为200 mL/min的氮气氛围下等温热解,分别得到生物炭WCL-X(X代表370, 420, 520, 620, 720, 820 ℃的最终热解温度).原料的元素分析和工业分析分别在Vario MACROCHN和SDTGA5000上进行,得到的工业分析结果见表 1,无素分析(质量分数,%)结果为C 44.53,H 4.94,N 2.32,S 0.48,O 35.04,分子式为CH1.3261O0.5904N0.0447S0.0041. 由工业分析和元素分析结果可知,所选WCL的固定碳含量较低,挥发分含量较高[6].
图 1(Fig. 1)
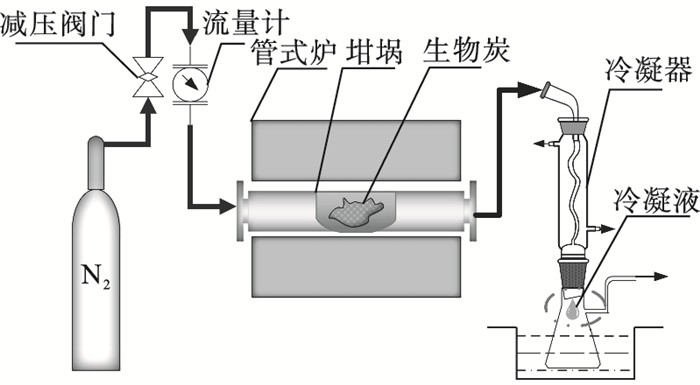 | 图 1 WCL-X热解固定床Fig.1 Experimental bench for WCL-X production |
表 1(Table 1)
| 表 1 WCL的工业分析和元素分析结果 Table 1 Industrial and elemental analysis of WCL |
1.2 生物炭材料表征使用热重分析仪(TG/DSC-FTIR)进行等温热解表征.称量约10 mg的WCL置于热解坩埚中,同时加载50 mL/min的惰性气体作为保护气.实验从室温上升至预定终温(420,520,620,720 ℃),并等温保持60 min.以达到终温时的质量作为初始质量,以达到热解终温时的时间作为初始时间;热解释放的气体在温度为200 ℃的传输线中传至FTIR分析仪处.傅里叶红外光谱仪从400~4 000 cm-1以4 cm-1的分辨率检测,每个样品扫描16次,记录输出气体红外光谱数据.
通过微激光拉曼光谱分析仪(HORIBA Lab RAM HR Evolution)得到WCL-X的拉曼信息,激光曝光时间为20 s,范围为500~4 500 cm-1;使用D8 Advance(Bruker, Germany)进行X射线衍射分析,以4°/min的扫描速度,在10° ~90°的范围内扫描WCL-X.
2 实验结果与讨论2.1 WCL等温热解气体演化与成焦特性关系分析图 2显示了WCL等温保持中的质量损失情况.假设到达每个热解终温下的质量分数为初始质量,记录时间为初始时间(T=0).在420,520,620 ℃的热解温度下,生物质样品的热重损失很少,最大质量损失不超过10%.然而,720 ℃发生了明显的失重,这说明高温下热解炭参与了二次反应.
图 2(Fig. 2)
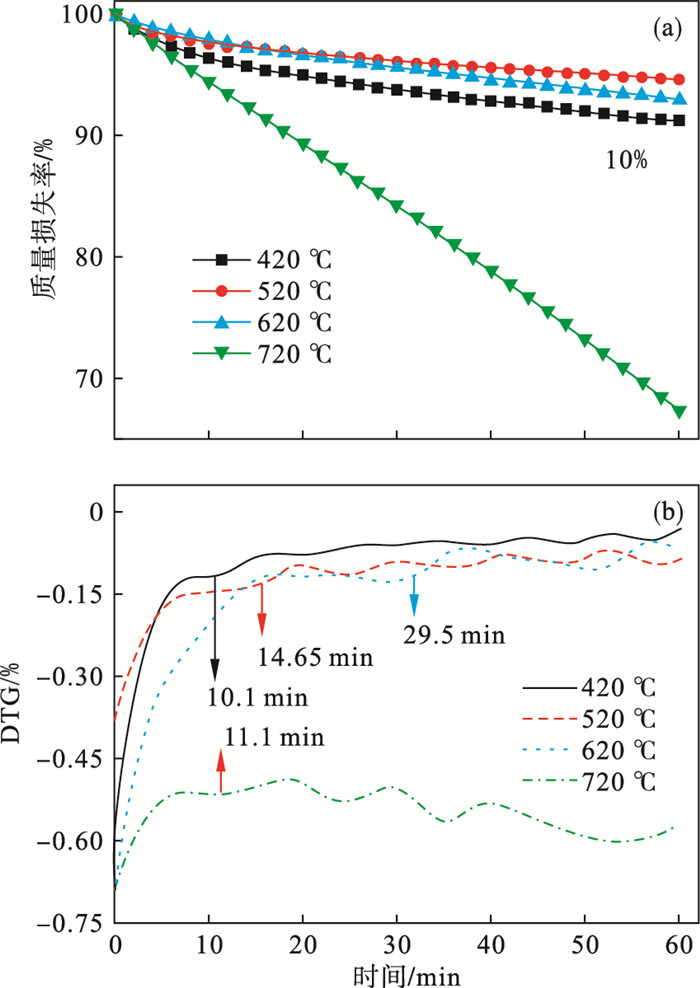 | 图 2 等温热解条件下WCL的TG-DTG曲线Fig.2 TG-DTG curves of WCL during isothermal pyrolysis (a)—TG曲线;(b)—DTG曲线. |
一般认为纤维素、半纤维素、木质素的主要热解温度区间分别为252.6~367.2 ℃,166.1~302.3 ℃,180.8~574.3 ℃.在之前的研究中已经提到WCL原料整个热解行为可以分为5个阶段,同时还伴随着各种化合物(CH4、CO2、酚类、醇类等)的产生[6].高温下醇、酚、有机酸和烯烃的产量较低,CO2产量显著增加,低温热解(520 ~620 ℃)可以用来生产生物炼制化合物.图 3给出了从升温开始到恒温保持过程中热解气体红外规律演化图,较低温度状态(420和520 ℃)下,主要是组分热解反应占据主导地位;较高温度状态(620和720 ℃)下,主要发生二次重整反应.升温过程也是热解反应发生和气体产生的过程,通常热解气产生峰值在这一阶段,而等温热解阶段主要进行慢速成焦阶段.Tahir等[13]指出低温有利于能量回收,而且时间对产物的浓度没有明显影响.因此,生物质的能量回收要聚焦不同的工艺条件,注重热解气品质可以聚焦升温速率和热解终温的工艺优化,而生物炭的生产则需要着重改善热解终温和等温保持时间等条件.
生物炭理化性质与表面官能团、碳骨架结构等相关.本文主要分析等温热解阶段的气体释放行为,从而来推测该温度条件下生物炭的理化性质.低温热解炭有高的表面官能团丰度,—OH,C=O,C—C等官能团的数量会增多,可以应用于土壤改良等[14];而高温生物炭结构会更有规律,出现类石墨化结构,可以用于制作碳基电化学材料等[15].从一定程度上讲,气体的析出规律与生物炭的理化性质是息息相关的.最近的研究已经验证了用TG-FTIR方法分析不同热解温度下的气体产物分布的准确性,可以在线监测和揭示气体演化规律[16].这说明通过TG-FTIR预测生物炭的演变机理是可行的.图 3给出不同温度下的气体演化路线,表 2量化了等温热解阶段通过FTIR监测的每一种气体产物的质量分数.根据图 3可知,WCL在热解过程中释放的不凝结气体主要为甲烷(CH4)、二氧化碳(CO2)和一氧化碳(CO),累计占热解气体的30%左右.H2O的生成与低温状态下WCL中自由水的脱离和较高温度下的脱水缩合反应有关,这意味着生物炭表面的羟基会随着温度的变化呈现先减小后升高的趋势;在所有温度下,在2 200 ~ 2 400 cm-1和2 000 ~ 2 200 cm-1有明显的红外峰,强度明显高于其他气体,这与CO2和CO的C=O伸缩振动分不开,它们的含量变化在低温状态(420和520 ℃)下与醚键、羰基和羧基有关[17],在高温状态(720 ℃)下与焦油化合物的二次裂解有关,如CH3COOH的质量分数从420 ℃下的3.63%增加到620 ℃条件下的11.67%,而720 ℃下的质量分数则又降到了7.41%的水平,推断生物炭表面的含氧官能团会随着温度的升高而降低;CH4的质量分数比CO2低得多,范围在1.52%~9.21%之间,它的生成与原料脂肪族侧链的断裂和甲氧基的去甲基化行为有关[6].CH4的产生始于200 ℃左右,在400 ℃时达到峰值,之后逐渐减少,预测低温生物炭(如420 ℃)表面的脂肪族官能团最低,而500 ℃左右生成的生物炭脂肪族官能团可能会较高,之后由于侧链断裂反应和去甲基反应已完全完成,脂肪族官能团处于一个较低水平.整个热解升温的过程也是生物炭芳香结构不断变化的过程,以C6H5OH为芳香族代表物,在520~620 ℃温度范围内达到较高水平,超过10%,在620 ℃的条件下甚至达到了气体质量分数的16.59%,这样的规律与该温度条件下木质素的分解有关.有研究认为,CO2对煤焦会有结构上的影响,可以防止碳焦结构的聚并和堆积[18].在高温条件(720 ℃)下,CO2处于一个相对较高的水平,再加上温度助力苯系化合物开环缩合形成稳定大苯环结构,预测高温下的生物炭是具有低水平的芳香结构.
图 3(Fig. 3)
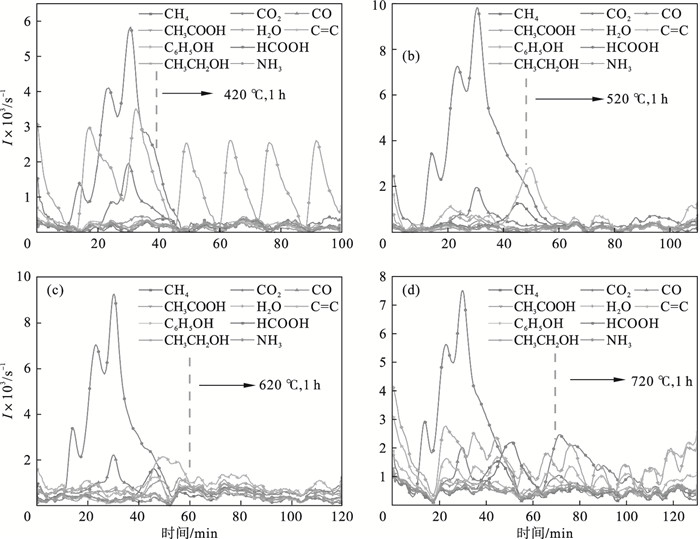 | 图 3 WCL不同温度热解气体演化Fig.3 Pyrolysis gas evolution of WCL (a)—420 ℃;(b)—520 ℃;(c)—620 ℃;(d)—720 ℃. |
表 2(Table 2)
| 表 2 等温热解过程主要析出气体及其产率(红外光谱) Table 2 Dominant gases precipitated during isothermal pyrolysis and their yields(FTIR) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2.2 FTIR预测下的生物炭特性WCL-X表面含有丰富的官能团,检测到的主要官能团包括与酚、醇和羧酸官能团相关的—OH(3 459 cm-1)的轴向变形;脂肪族C—H(2 862和2 921 cm-1);酚醛类C—OH(1 187和1 260 cm-1);芳香C=C在基团间的拉伸(1 659 cm-1);芳香族C—H(749, 836, 874和3 029 cm-1); 多糖C—O延伸(1 044 cm-1)[17].由图 4a可以看出,不同热解温度下生物炭的红外结构有明显的变化.WCL-X的表面官能团随温度的不同而发生显著变化.值得注意的是,O—H峰的降低是由于热解过程中的脱水造成的.3 049 cm-1的峰在WCL-X光谱中消失,这是由于挥发物的损失.此外,1 695 ~ 1 720 cm-1之间的吸收峰是由羰基(C=O)的伸缩振动引起的[6].当热解温度超过620 ℃时,WCL-X中的羰基几乎完全消失,因为C=O双键主要存在于已完全热解的半纤维素和纤维素中.1 659 cm-1附近的峰对应于芳香环的振动,表明在420~720 ℃的过程中存在芳香化合物.值得注意的是,520 ℃作为边界温度点时,芳香峰强度呈现先增大后减小的变化趋势.推测WCL在高温下被石墨化同时伴随着脱氢缩合反应.图 4b给出典型官能团红外光谱峰面积参数.由图可知,所有样品中含氧官能团和芳香基团的比例都较大.WCL-420的含氧官能团含量最高,而WCL-520的羟基含量最低,脂肪族的比例最高.其次,WCL-620含有较多的芳香基团.这与热解炭从形成芳香环结构到致密环结构的逐渐变化相对应.而Guo等[19]证实了含氧官能团等随着温度(< 500 ℃)呈现出一定的变化规律.总之,随着热解温度的变化,生物炭的理化性质可能发生变化,羟基、脂肪族C—H键、C=O和C—O的含量不断降低,芳香度先升高后降低.
图 4(Fig. 4)
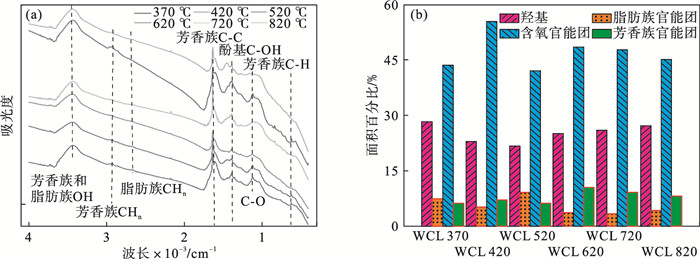 | 图 4 不同WCL-X的官能团演变规律Fig.4 The functional group evolution of different WCL-X (a)—FTIR图;(b)—外光谱吸收峰面积. |
2.3 等温热解生物炭的XRD特性分析XRD谱图如图 5a所示, 采用经验公式得到不同温度WCL-X的微观结构参数:横向尺寸(La)、堆积高度(Lc)、碳层间距(d002)[20], 分别对应式(1)、式(2)和式(3),得到如图 5b晶体结构参数.
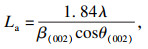 | (1) |
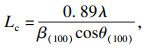 | (2) |
 | (3) |
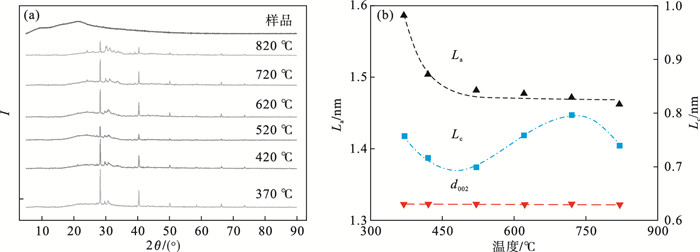 | 图 5 不同热解温度生物炭的XRD结果分析Fig.5 XRD spectra of biochar at different pyrolysis temperature (a)—不同WCL-X的XRD;(b)—不同WCL-X的结构参数. |
式中:λ=0.154 1 nm;θ(002),θ(100)分别代表碳结构中(002)面和(100)面的衍射角;β(002),β(100)分别代表(002)面和(100)面的半峰宽高.
在20°~24°范围内检测到宽峰,对应半纤维素和木质素的无定形形态和纤维素的晶体结构, 峰值强度随热解温度的升高而降低,表明热解温度下生物质结构发生了正向破坏,这与TGA的结果一致.同时,温度促进了2θ=28°的峰出现.这个峰代表一种结构相对规则的含碳物质.对于所有的WCL-X样品,在2θ=41°附近观察到一个宽波段,这假设非晶态炭是非均质材料.不同热解温度下石墨微晶层间距基本不变(约为0.315 nm),说明温度对微晶结构间距d002几乎没有影响.在温度小于520 ℃时,横向尺寸(La)先减小,然后随着温度的升高保持稳定的趋势.温度小于520 ℃时,堆积高度(Lc)呈先减小后增大的趋势.以上变化说明了热解温度促进碳微晶结构的形成.同时,从结果推测,半纤维素、纤维素等晶体结构被破坏,出现一些非晶态碳结构,大量脂肪侧链脱落,挥发物析出,WCL-X趋于形成致密的大芳香结构.
2.4 等温热解生物炭的Raman特性分析如图 6a所示,随着热解温度的升高,拉曼光谱的总面积呈现出先增大后减小的趋势.研究表明,总拉曼强度受WCL-X的含氧结构和芳香性的影响.在600 ℃左右,取代基的损失和芳香环的缩合加剧.当温度高于520 ℃时,含氧官能团大量消耗,开始形成大苯环结构.D段和G段通常代表无序结构,其中石墨结构最为明显,都随温度的变化而变化.随着热解温度的升高,D波段从370 ℃时的1 343 cm-1移至820 ℃时的1 330 cm-1, G波段位置移至更高的波数(从370 ℃时的1 561 cm-1移至820 ℃时的1 588 cm-1).正是含氧官能团的缺失和大芳香体系的形成导致了拉曼强度的降低.
图 6(Fig. 6)
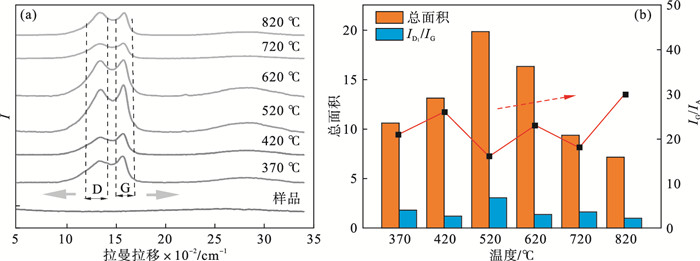 | 图 6 不同热解温度生物炭的Raman结果分析Fig.6 Raman analysis of WCL-X (a)—不同WCL-X的拉曼光谱;(b)—不同WCL-X的结构比例. |
为了获得WCL的详细信息,将拉曼光谱反卷积成几个高斯-洛伦兹波段带, 发现了G(1 580~1 600 cm-1),D1(1 590~1 650 cm-1),D2(1 330~1 350 cm-1),D3(1 460~1 525 cm-1)和D4(1 170-1 200 cm-1)的光谱段位置,结果如图 7和表 3所示.G带对应于石墨晶体芳香层的伸缩振动,D1归因于石墨层的晶格振动,强度随石墨程度的增加而降低[18].直观来说,在不同的WCL-X中D1和G两波段比其他波段的强度更高.表 3利用ID1/IG和IG/IA的面积比来研究无序碳的微观结构和石墨碳的程度.如图 7b所示,研究中ID1/IG的比值表明了芳香环体系的发展或缺陷.ID1/IG的值从370 ℃的1.87增加到520 ℃的3.07,超过520 ℃后下降至0.98.一般认为,ID1/IG的值越高,石墨晶粒的平面尺寸越小,各种形态半焦中结构缺陷的比例越高.WCL-520中的芳香环体系开始发展,含有6个或6个以上融合苯环的芳香环的浓度相对增加,生物炭结构由无序开始变得有序,这也是IG/IA逐渐增大的原因.Binnal等[21]制备的稻壳衍生生物炭表现出良好有序的碳结构(IG/IA=0.199).从这些可以推测,520 ℃可能是WCL的热解特征点.在这个温度之前,WCL处于组分热解挥发阶段,微观碳结构趋向形成缺陷;此温度之后,石墨、大芳香环等结构开始形成,微观碳结构趋于有序.
图 7(Fig. 7)
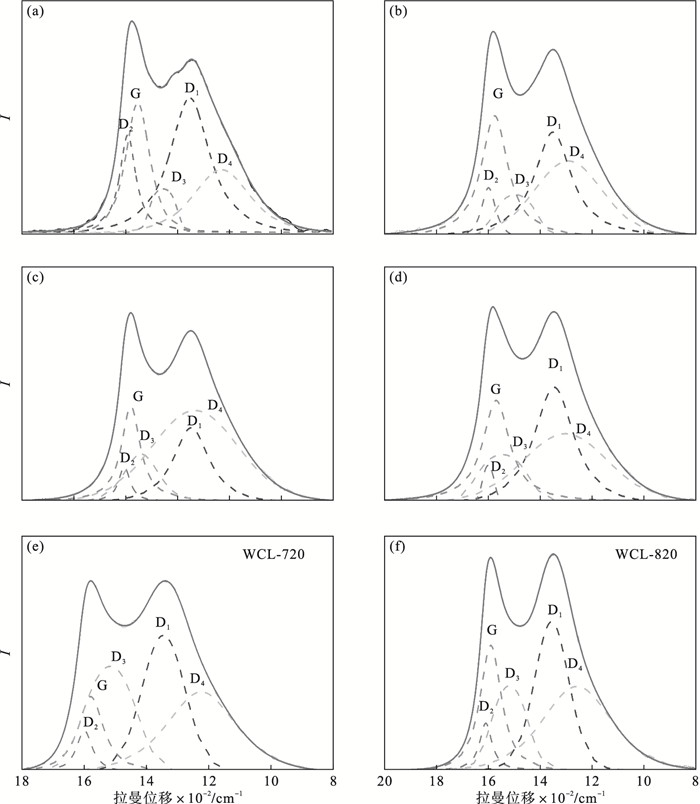 | 图 7 拉曼光谱拟合图Fig.7 A diagram of Raman spectral fitting (a)—WCL-370; (b)— WCL-420; (c)—WCL-520; (d)—WCL-620; (e)—WCL-720; (f)—WCL-820. |
表 3(Table 3)
| 表 3 生物炭WCL-X的拉曼结构分析 Table 3 Carbon microstructure parameters of WCL-X from Raman |
3 结论1) 本文以等温热解为切入点,探究了WCL生物炭理化性质随温度的变化规律.
2) 温度是影响WCL生物炭理化性质的重要因素,高温WCL-X的羟基、脂肪族C—H键、C=O和C—O等表面官能团被大量消耗,结构由无序趋于有序.
3) 热解过程中气体的演化行为和生物炭表面官能团以及微观结构的演变规律相关,如CO2和CO与羰基和羧基、CH4和脂肪族官能团、CH3COOH和含氧官能团、C6H6OH和生物炭的芳香度,这样的发现有利于定向调控生产不同应用的生物炭.
4) 对于WCL而言,520 ℃是WCL的热解特征点,比如等温热解质量损失最小、拉曼光谱总面积最大、横向尺寸(La)变化趋于平缓等.通过生物质热解特征来进行分段特征研究是有意义的.
参考文献
| [1] | Peduzzi E, Boissonnet G, Haarlemmer G, et al. Torrefaction modelling for lignocellulosic biomass conversion processes[J]. Energy, 2014, 70: 58-67. DOI:10.1016/j.energy.2014.03.086 |
| [2] | Zhu X, Qian W, Li X, et al. Moisture adsorption and spontaneous combustion characteristics of biomass wastes after degradative solvent extraction[J]. Fuel, 2020, 266: 117109. DOI:10.1016/j.fuel.2020.117109 |
| [3] | Qiao Y, Xu F, Ming X, et al. Valorization of vegetable waste via pyrolysis: thermal behavior, volatiles release, and products analysis from its extractives[J]. Energy & Fuels, 2020, 34(2): 1896-907. |
| [4] | Zhou H, Long Y, Meng A, et al. The pyrolysis simulation of five biomass species by hemi-cellulose, cellulose and lignin based on thermogravimetric curves[J]. Thermochimica Acta, 2013, 566: 36-43. DOI:10.1016/j.tca.2013.04.040 |
| [5] | Pradhan S, Shahbaz M, Abdelaal A, et al. Optimization of process and properties of biochar from cabbage waste by response surface methodology[J]. Biomass Conversion and Biorefinery, 2020, 12(12): 5479-5491. |
| [6] | Zhang Y, Cheng X, Wang Z, et al. Full recycling of high-value resources from cabbage waste by multi-stage utilization[J]. Science of the Total Environment, 2022, 804: 149951. DOI:10.1016/j.scitotenv.2021.149951 |
| [7] | Jankovi? B, Mani?N, Dodevski V. Pyrolysis kinetics of Poplar fluff bio-char produced at high carbonization temperature: a mechanistic study and isothermal life-time prediction[J]. Fuel, 2021, 296: 120637. DOI:10.1016/j.fuel.2021.120637 |
| [8] | Ikegwu U M, Ozonoh M, Daramola M O. Kinetic study of the isothermal degradation of pine sawdust during torrefaction process[J]. ACS Omega, 2021, 6(16): 10759-10769. DOI:10.1021/acsomega.1c00327 |
| [9] | Genieva S, Gonsalvesh L, Georgieva V, et al. Kinetic analysis and pyrolysis mechanism of raw and impregnated almond shells[J]. Thermochimica Acta, 2021, 698: 178878. |
| [10] | Mettler M S, Vlachos D G, Dauenhauer P J. Top ten fundamental challenges of biomass pyrolysis for biofuels[J]. Energy & Environmental Science, 2012, 5(7): 7797-7809. |
| [11] | Silveira E A, Luz S M, Le?o R M, et al. Numerical modeling and experimental assessment of sustainable woody biomass torrefaction via coupled TG-FTIR[J]. Biomass and Bioenergy, 2021, 146: 105981. DOI:10.1016/j.biombioe.2021.105981 |
| [12] | Dun W, Guijian L, Ruoyu S, et al. Investigation of structural characteristics of thermally metamorphosed coal by FTIR spectroscopy and X-ray diffraction[J]. Energy & Fuels, 2013, 27(10): 5823-5830. |
| [13] | Tahir M H, Mubashir T, Schulze M, et al. Thermochemical conversion of cabbage waste to bioenergy and bio-chemicals production[J]. International Journal of Energy Research, 2022, 46(14): 20206-20215. DOI:10.1002/er.8303 |
| [14] | Sarwar A, Ali M, Khoja A H, et al. Synthesis and characterization of biomass-derived surface-modified activated carbon for enhanced CO2 adsorption[J]. Journal of CO2 Utilization, 2021, 46: 101476. DOI:10.1016/j.jcou.2021.101476 |
| [15] | Li B, Liu D, Lin D, et al. Changes in biochar functional groups and its reactivity after volatile-char interactions during biomass pyrolysis[J]. Energy & Fuels, 2020, 34(11): 14291-14299. |
| [16] | Tahir M H, Mubashir T, Hussain M B, et al. Selective catalytic conversion of tea waste biomass into phenolic-rich bio-oil and subsequent extraction[J]. Journal of Analytical and Applied Pyrolysis, 2021, 159: 105315. DOI:10.1016/j.jaap.2021.105315 |
| [17] | Tahir M H, Cheng X, Irfan R M, et al. Comparative chemical analysis of pyrolyzed bio oil using online TGA-FTIR and GC-MS[J]. Journal of Analytical and Applied Pyrolysis, 2020, 150: 104890. DOI:10.1016/j.jaap.2020.104890 |
| [18] | Wang B, Sun L, Su S, et al. Char structural evolution during pyrolysis and its influence on combustion reactivity in air and oxy-fuel conditions[J]. Energy & Fuels, 2012, 26(3): 1565-1574. |
| [19] | Guo H, Ogawa S, Isoda Y, et al. Weak-acid biochar catalyst prepared from mechanochemically-activated biomass and humic acid for production of 5-hydroxymethylfurfural[J]. Biochar, 2022, 4(1): 1-13. DOI:10.1007/s42773-021-00127-w |
| [20] | Jiang J, Yang W, Cheng Y, et al. Molecular structure character ization of middle-high rank coal via XRD, Raman and FTIR spectroscopy: implications for coalification[J]. Fuel, 2019, 239: 559-572. DOI:10.1016/j.fuel.2018.11.057 |
| [21] | Binnal P, Kumar D J, Sasalu Parameshwaraiah M, et al. Upgrading rice husk biochar characteristics through microwave-assisted phosphoric acid pretreatment followed by co-pyrolysis with LDPE[J]. Biofuels, Bioproducts and Biorefining, 2022, 16(5): 1254-1273. DOI:10.1002/bbb.2392 |
