
 , 陈婉晴3, 佟冰3
, 陈婉晴3, 佟冰3 1. 东北大学 材料科学与工程学院, 辽宁 沈阳 110819;
2. 东北大学 材料各向异性与织构教育部重点实验室, 辽宁 沈阳 110819;
3. 抚顺罕王傲牛矿业股份有限公司, 辽宁 抚顺 113125
收稿日期:2021-12-07
基金项目:国家自然科学基金资助项目(52071070, 51871045); 中央高校基本科研业务费专项资金资助项目(N2017003, N2102004)。
作者简介:李婷(1996-), 女, 福建南平人, 东北大学硕士研究生;
裴文利(1970-), 男, 辽宁沈阳人, 东北大学教授, 博士生导师。
摘要:采用商业磁铁矿铁精粉(Fe3O4), 设计了提纯和制备工艺, 成功制备出质量分数为99.5%以上、分散性良好的α-Fe2O3纳米粒子,对其提纯、制备工艺及机理进行了深入研究. 结果表明: wNaOH对除硅效果影响显著, 当wNaOH为39 %时, 可使原料矿粉中wSiO2由1.11 %降至0.032%, 得到较纯铁精粉; 随烧结温度的升高, α-Fe2O3颗粒的结晶度、形貌特征及磁性能随之发生变化; 当烧结温度为670 ℃时, α-Fe2O3颗粒综合性能最佳, 颗粒结晶度较高、分散性较好, 具有亚铁磁性; 通过对氢氧化铁沉淀物加热搅拌时间的控制, 可有效调控α-Fe2O3的晶粒尺寸;当搅拌时间为60 min时, 获得分散性好、平均粒径仅为35.3 nm的α-Fe2O3纳米粒子.
关键词:α-Fe2O3铁精粉纳米颗粒晶粒尺寸分散性
Preparation and Mechanism of α-Fe2O3 Nanoparticles by Using Iron Concentrate Powder
LI Ting1,2, PEI Wen-li1,2

 , CHEN Wan-qing3, TONG Bing3
, CHEN Wan-qing3, TONG Bing3 1. School of Material Science & Engineering, Northeastern University, Shenyang 110819, China;
2. Key Laboratory for Anisotropy and Texture of Materials Ministry of Education, Northeastern University, Shenyang 110819, China;
3. Fushun Hanking Aoniu Mining Co., Ltd., Fushun 113125, China. Corresponding author: PEI Wen-li, E-mail: peiwl@atm.neu.edu.cn
Corresponding author: PEI Wen-li, E-mail: peiwl@atm.neu.edu.cn.
Abstract: Using commercial magnetite iron powder(Fe3O4), a purification and preparation process was designed, and α-Fe2O3 nanoparticles with a mass fraction of more than 99.5% and good dispersibility were successfully prepared. The purification, preparation process and mechanism were studied in detail. The results show that: wNaOH has a significant impact on the effect of silicon removal, when wNaOH is 39 %, the wSiO2 in the raw ore powder can be reduced from 1.11 % to 0.032 % to get more pure iron fine powder. With the increase of the sintering temperature, the crystallization, appearance characteristics and magnetic properties of α-Fe2O3 particles have changed. When the sintering temperature is 670 ℃, the comprehensive performance of α-Fe2O3 particles is the best, including higher particle crystallinity, good dispersibility and ferrimagnetic properties. By controlling the heating and stirring time of the hydroxide sediment, the grain size of the α-Fe2O3 can be effectively regulated. When the stirring time is 60 min, the α-Fe2O3 with a high-quality dispersability and a average particle size of only 35.3 nm is obtained.
Key words: α-Fe2O3iron concentrate powdernanoparticlesgrain sizedispersion
α-Fe2O3纳米材料化学稳定性好[1], 具有优良的光学、半导体、磁学等性能, 是重要的功能性材料. 作为典型的n型半导体材料[2], 禁带宽度为2.1 eV, 可吸收波长小于560 nm的太阳光且具有气敏特性, 奠定了α-Fe2O3在光催化降解污水[3]及气体传感器[4]方面的应用基础.以α-Fe2O3为铁源制备LiFePO4/C锂电池正极材料[5], 具有安全系数高、优越的比容量和循环稳定性等优势.由于α-Fe2O3颜色艳丽、安全无毒、环境友好、生物兼容性好、成本低廉等特性[6-7], 在颜料[8]及抗真菌材料[9]等方面均有应用, α-Fe2O3是合成高性能软磁铁氧体的主要原料[10].α-Fe2O3纳米粒子具有重要应用价值和广泛的应用前景[11-12].
通常α-Fe2O3纳米材料的制备方法有干法和湿法: 干法[13-14]主要包括化学气相沉积、激光气相沉积、固相化学反应法等, 通过干法制备得到的颗粒尺寸大且难以控制; 湿法[15-17]主要包括水热合成法、溶胶-凝胶法、微乳液法、共沉淀法等, 其中共沉淀法具有制备工艺简单、合成成本低、反应温度较低、产物结晶性好、纯度高等优势而被广泛应用. Lassoued等[18]通过共沉淀法合成尺寸为21~38 nm的α-Fe2O3颗粒, 并证明其具有约2.1 eV的能带间隙及可控磁学性能.鲁秀国等[19]以氨水为沉淀剂采用简单的化学共沉淀法制备了分散性高、均匀度好的α-Fe2O3颗粒, 粒径约为50 ~ 70 nm. 在目前α-Fe2O3高纯纳米粒子制备的报道中, Fe源均使用分析纯化学试剂, 如六水合氯化铁、七水合硫酸亚铁等, 合成成本高, 难以实现大规模量产.
铁精粉是铁矿石经破碎、磁选、浮选等工艺处理后获得, 主要成分为Fe2O3或Fe3O4, 成本低廉、原料丰富、产品质量稳定, 是球团炼铁的重要原料. 采用工业提纯法合成α-Fe2O3粉末[20], 但成品产物粒径分布不均匀、分散性差, 实验缺乏对α-Fe2O3粒子形成机理的关注. 铁精矿粉中含有质量分数较高的SiO2等杂质, 提纯困难, 因此直接利用铁精粉制备纳米级α-Fe2O3粉末一直难以应用.
针对上述问题, 采用商业铁精粉为原料, 通过提纯与共沉淀工艺相结合的方法, 直接合成纳米级α-Fe2O3, 研究合成工艺对α-Fe2O3粒子尺寸、形貌和成分的影响, 揭示实验反应原理及合成工艺对α-Fe2O3粒径的影响, 为铁精粉制备纳米级α-Fe2O3提供理论和实验依据.
1 实验材料及方法1.1 实验材料实验所用Fe源为商业铁精粉, 铁精粉的XRD及SEM如图 1所示, 经XRD检测得其主要成分为Fe3O4.原料铁精粉形状不一, 尺寸不均, 经统计其平均粒径约为33.7 μm. 铁精粉中的杂质及其质量分数如表 1所示.
图 1(Fig. 1)
 | 图 1 铁精粉的XRD,SEM分析及粒径统计Fig.1 XRD, SEM analysis and particle size statistics of iron concentrate powders (a)—铁精粉的XRD图;(b)—铁精粉的SEM图;(c)—铁精粉的粒径统计. |
表 1(Table 1)
| 表 1 铁精粉中的杂质及其含量(质量分数) Table 1 Impurities and their content in iron concentrate powders(mass fraction)? | ||||||||||||||||||||||||||||||||||||||||||||||||
铁精粉中的杂质主要包括SiO2,Al2O3,CaO,MgO及SO42-, 其中的主要杂质SiO2较难去除, 其质量分数为1.11 %.
实验所用材料为氢氧化钠(粒状, 分析纯)、盐酸(分析纯)、碳酸氢氨(分析纯), 国药公司; 去离子水, 沈阳鑫科实验用品有限公司.
1.2 实验方法制备高纯α-Fe2O3实验流程如图 2所示. 取60 g铁精粉于球磨机中球磨5 h, 其平均粒径达1 μm左右, 有利于铁精粉与碱液充分接触并反应. 室温下, 在25 mL水中分别缓慢加入8, 12, 14, 16 g的NaOH颗粒, 并充分搅拌, 配制wNaOH分别为24 %,32 %,36 %,39 %的溶液, 将其分别与5 g超细铁精粉充分混合, 于180 ℃保温3 h碱洗除杂, 冷却至室温并用去离子水充分过滤洗涤, 去除可溶性硅酸盐.将除杂后的铁精粉转移到100 mL玻璃皿中, 加入25 mL盐酸及27 mL水, 于空气气氛下60 ℃恒温搅拌2 h, 形成铁盐溶液. 在铁盐溶液中缓慢加入饱和NH4HCO3溶液作为碱源, 调节pH为7.5, NH4HCO3与铁盐溶液发生化学反应生成氢氧化铁胶体沉淀物. 将所得氢氧化铁胶体沉淀物于65 ℃恒温搅拌0~1 h, 用去离子水充分抽滤洗涤;用去离子水将样品整理至培养皿中, 于60 ℃鼓风干燥8 h, 此时氢氧化铁胶体沉淀物因部分脱水而形成羟基氧化铁; 将干燥样品充分研磨, 并于管式炉中420 ~ 800 ℃敞口恒温煅烧3 h, 待炉体冷却至室温后将样品取出, 得到纳米级α-Fe2O3粉末.
图 2(Fig. 2)
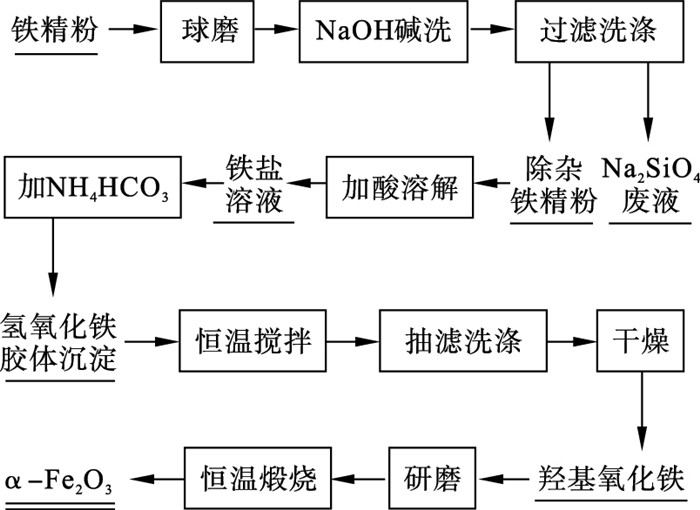 | 图 2 铁精粉制备高纯α-Fe2O3实验流程Fig.2 Experimental process of preparing high-purity α-Fe2O3 from iron concentrate powders |
1.3 材料表征利用EDX4500型X射线荧光检测, Agilent7800型电感耦合等离子质谱仪对粉末样品进行成分定性和定量分析. 采用Smartlab型X射线衍射仪对粉末样品进行物相分析, 采用JSM-7001F型场发射扫描电子显微镜对样品进行形貌分析, 采用EZ-9型振动样品磁强计对Fe2O3样品磁性能检测, 采用JSM-6510A透射电子显微镜对样品微观粒径检测.
2 结果与讨论2.1 提纯工艺研究2.1.1 碱洗提纯工艺铁精粉中的杂质以较难去除的SiO2为主, 在碱洗工艺中, 定量检测不同碱洗条件下铁精粉中SiO2的剩余含量.铁精粉为5 g, wNaOH分别为0, 24%, 32%, 36%, 39%时, 铁精粉中的wSiO2分别为1.11%, 0.21%, 0.15%, 0.045%, 0.032%.可以看出, 铁精粉中wSiO2随wNaOH的增加而降低, 这是因为铁精粉中呈酸性的SiO2与NaOH反应, 生成硅酸盐, 溶解于碱液中, 而铁的氧化物不与NaOH溶液发生反应, 可通过过滤洗涤去除硅酸钠, 达到除硅的目的. 若继续增加wNaOH, 易造成清洗不当引入多余Na杂质, 降低成品纯度. 因此, 采用wNaOH为39%时, 可大幅降低铁精粉中wSiO2.
2.1.2 提纯反应原理铁精粉中的Fe3O4不会与NaOH溶液发生反应, 而其中难去除的主要杂质SiO2在加热环境下会与NaOH溶液发生反应, 生成硅酸钠, 并在搅拌实验条件下, 有利于SiO2与NaOH溶液充分接触并反应. 反应方程式为
 |
 |
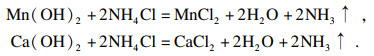 |
铁精粉经加碱除杂、充分清洗、溶成铁盐、沉淀、抽滤洗涤、60 ℃干燥、烧结等步骤后得到α-Fe2O3, 对得到的α-Fe2O3样品进行X射线荧光定性分析, 详见表 2. 结果表明, 经过实验流程制备得到的α-Fe2O3样品与原料铁精粉相比, 已经减少了Mg, Ca, SO42-, Mn杂质.同时还对该样品进行化学元素定量检测, 并与现行的国标GB/T 24244—2009 《铁氧体用氧化铁》[21]中的YHT5牌号进行一一对比, 结果表明产品质量完全符合GB/T 24244—2009中YHT5牌号的标准, 结果如表 3所示.
表 2(Table 2)
| 表 2 α-Fe2O3成品的X荧光定性分析 Table 2 X-ray fluorescence qualitative analysis of α-Fe2O3? | ||||||||||||||||||||||||||||||||||||||||
表 3(Table 3)
| 表 3 产品质量对照 Table 3 Product quality comparison |
2.2 合成工艺对粒子形貌、尺寸和性能的影响2.2.1 工艺路线分析在铁精粉制备α-Fe2O3的工艺路线中, 出现两个未知成分的中间产物, 即水解沉淀产物及干燥脱水产物, 因此进行XRD分析, 如图 3所示.图中黑色曲线为水解沉淀产物的XRD图谱, 在2θ为30.81°,35.02°,43.04°,57.56°,62.73°处的衍射峰与Fe(OH)3的标准图谱(JCPDS#22-0346)一一对应, 证明水解沉淀产物为Fe(OH)3.图中红色曲线为干燥脱水产物的XRD图谱, 可知特征衍射峰在2θ为21.24°,26.34°,36.62°,41.15°,53.18°处, 与α-FeO(OH)标准图谱(JCPDS#17-0536)对应, 表明干燥脱水产物为α-FeO(OH).
图 3(Fig. 3)
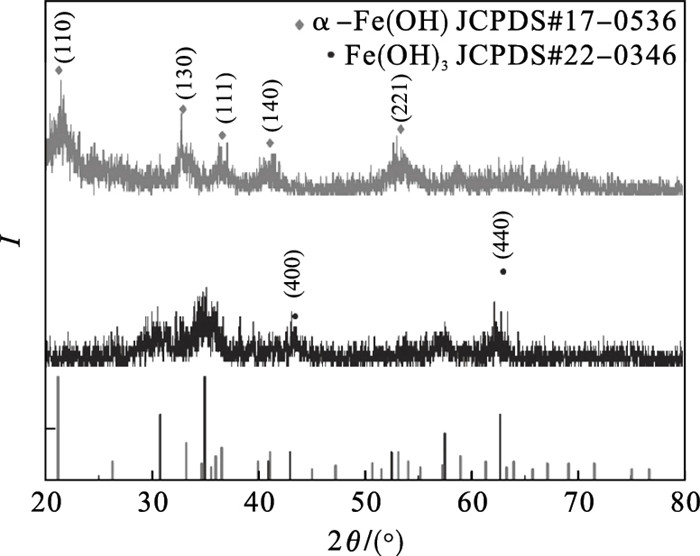 | 图 3 水解沉淀产物和干燥脱水产物的XRD图Fig.3 XRD patterns of hydrolyzed precipitation product and dried dehydration product |
中间产物Fe(OH)3和α-FeO(OH)的TEM如图 4所示.图 4a是水解沉淀产物Fe(OH)3的TEM, 可知未经热处理的Fe(OH)3无规则形貌, 有大小不一的团簇分布其中;图 4b是团簇体的高分辨TEM, 发现大团簇由粒径约3~ 6 nm颗粒组成, 结晶性较差.图 4c为干燥脱水产物α-FeO(OH)的TEM, 观察发现, 其以球状团簇的形态存在, 大团簇由许多10 ~ 20 nm的针状α-FeO(OH)组成.图 4d为α-FeO(OH)的高分辨TEM, 可以清楚地看到纳米针状形貌及清晰的晶格条纹.Fe(OH)3在60 ℃过夜干燥且富含去离子水的条件下, 不断脱水并沿(110)方向排列形成针铁矿α-FeO(OH), 随水分蒸发, α-FeO(OH)不断团聚挤压, 最终干燥成块状固体.将干燥固体研磨成粉末, 通过透射分析可知, 该粉末微观形貌是由许多针状α-FeO(OH)组成的α-FeO(OH)球状团簇.
图 4(Fig. 4)
 | 图 4 中间产物Fe(OH)3和α-FeO(OH)的TEM图Fig.4 TEM image of the intermediate product Fe(OH)3 and α-FeO(OH) (a), (b)—Fe(OH)3; (c), (d)—α-FeO(OH). |
通过表征手段及分析, 确定了在由铁精粉合成α-Fe2O3过程中产生的两个重要中间产物分别是Fe(OH)3和α-FeO(OH), 因此, 分析以下铁精粉制备α-Fe2O3的工艺路线.
铁精粉经碱洗除杂后, 加入盐酸溶解, 化学反应式为
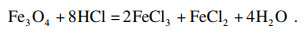 |
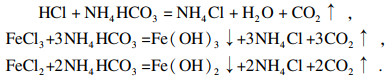 |
 |
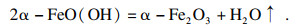 |
图 5(Fig. 5)
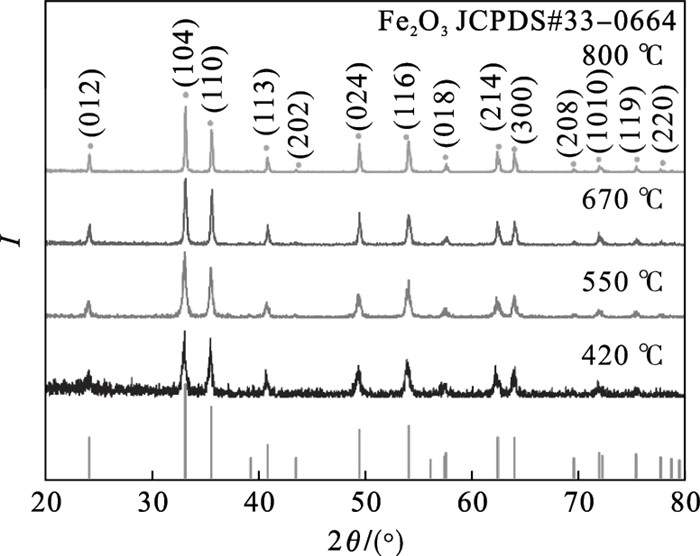 | 图 5 不同烧结温度下α-Fe2O3的XRD图Fig.5 XRD patterns of α-Fe2O3 at different sintering temperatures |
由图 4c可知, 干燥脱水产物α-FeO(OH)为针形α-FeO(OH)组成的球状团簇, 在高温烧结时α-FeO(OH)团簇不断脱水, 逐渐失去纳米针状形貌, 最后形成α-Fe2O3颗粒.
为了探究烧结温度对α-Fe2O3形貌的影响, 对经不同烧结温度得到的α-Fe2O3进行SEM分析, 如图 6所示.可知, 反应制备的α-Fe2O3样品微观形貌均为纳米颗粒. 当烧结温度为420 ℃时, 样品颗粒尺寸较小, 约为190 nm, 可能是由于烧结温度较低, 部分颗粒反应不充分还没有形成完好的晶型,如图 6a所示; 当烧结温度为550 ℃时,不难看出α-Fe2O3成晶状态得到改善, 样品颗粒感明显且大小均匀,如图 6b所示; 当烧结温度为670 ℃时, α-Fe2O3样品整体形貌好, 平均粒径增大至238 nm, 颗粒尺寸均一性好, 具有较好的分散性,如图 6c所示; 当烧结温度达到800 ℃时, α-Fe2O3纳米颗粒尺寸进一步增大, 约为290 nm, 且晶粒之间出现粘连现象, 可能是由于反应温度过高导致α-Fe2O3颗粒之间发生团聚烧结, 如图 6d所示.
图 6(Fig. 6)
 | 图 6 不同烧结温度下α-Fe2O3的SEMFig.6 SEM images of α-Fe2O3 at different sintering temperatures (a)—t=420 ℃; (b)—t=550 ℃; (c)—t=670 ℃; (d)—t=800 ℃. |
不同烧结温度下α-Fe2O3的室温磁滞回线如图 7所示, 可知在-1 591.6 ~1 591.6 kA/m外磁场施加范围下, 不同烧结温度α-Fe2O3样品的饱和磁化强度均没有达到饱和状态, 这与α-Fe2O3的磁性能一致[22]. 可知, 4个温度下烧结得到的α-Fe2O3在室温下均呈现弱铁磁性, 具有一定的矫顽力(Hc).
图 7(Fig. 7)
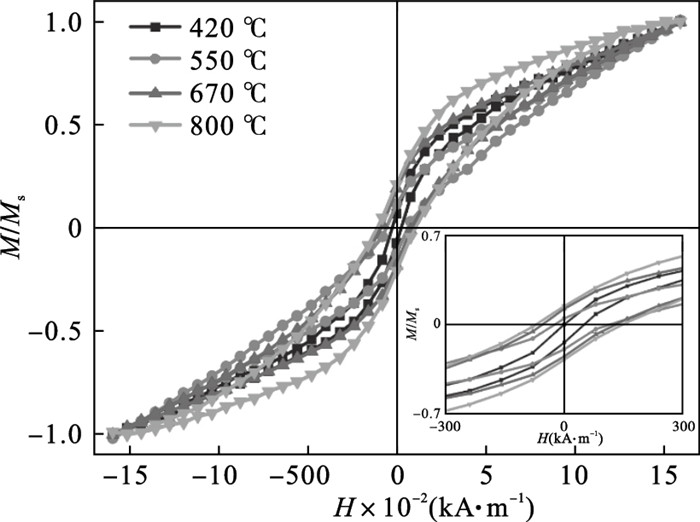 | 图 7 不同烧结温度下α-Fe2O3室温磁滞回线Fig.7 Room temperature hysteresis loop of α-Fe2O3 at different sintering temperatures |
当烧结温度为420 ℃时, α-Fe2O3的矫顽力为25.5 kA/m.随着烧结温度的升高, 样品的矫顽力呈增大趋势, 当烧结温度为550,670 ℃时, α-Fe2O3的矫顽力分别为61.0,87.3 kA/m. 当烧结温度为800 ℃时, α-Fe2O3的矫顽力增大到109.6 kA/m, 矫顽力较高, 这可能是由于在较高的烧结温度下, 颗粒长大引起矫顽力增大. 相关研究表明, α-Fe2O3的磁性能受样品形貌、尺寸大小及晶体结构的影响[22-24].
通过讨论不同烧结温度对α-Fe2O3样品结晶度、微观形貌及磁性能的影响, 当烧结温度为670 ℃时, 样品为单相α-Fe2O3且结晶性较高, 颗粒尺寸均匀、分散性好、具有亚铁磁性, 矫顽力为87.3 kA/m. 经检测, 在670 ℃烧结3 h后得到α-Fe2O3, wTFe为69.67 %, 即wα-Fe2O3为99.5%.
虽然颗粒具有较好分散性和尺寸均匀性, 但晶粒平均粒径较大, 为238 nm, 因此对如何减小α-Fe2O3晶粒尺寸进行深入探讨.
2.2.3 水解沉淀产物搅拌工艺的探究将得到的水解沉淀产物分别恒温加热搅拌0,20,40,60 min,经洗涤、干燥后于670 ℃烧结3 h,将得到的α-Fe2O3样品进行透射电镜分析, 结果如图 8a~8d所示. 可知, 沉淀物经不同搅拌时间并烧结后得到的α-Fe2O3纳米颗粒在透射电镜下均呈现不规则多边形形貌. 颗粒总体分散性较好, 部分有轻微团聚现象, 这是因为α-Fe2O3纳米粒子尺寸较小, 具有较高表面能, 且粒子具有一定磁性, 导致颗粒之间吸引力增强, 造成部分颗粒团聚. 在高分辨透射电镜下观察图 8d中圈出的颗粒, 即图 8e, 可以看到α-Fe2O3颗粒晶格条纹清晰可见, 颗粒结晶性好, 经标定为α-Fe2O3的(104)晶面. 对比图 8a~8d可知, 随沉淀物搅拌时间的延长, α-Fe2O3晶粒尺寸呈明显减小趋势. 对不同搅拌时间下α-Fe2O3纳米颗粒进行粒径统计, 并绘制粒径随搅拌时间的变化, 如图 8f所示.当沉淀产物未经搅拌时, 烧结后α-Fe2O3平均粒径为238.2 nm, 且样品的平均粒径随搅拌时间的增加而下降, 当搅拌时间为60 min时, 纳米粒子平均粒径仅为35.3 nm. 可见随搅拌时间的延长, 烧结的α-Fe2O3平均粒径越细小, 这是因为搅拌条件下在溶液边界层产生的剪应力会破碎原有晶体, 不断形成微小粒子, 发生大量的二次成核[24], 恒温条件为二次成核的晶核结晶提供条件;搅拌有利于防止胶粒团聚现象[25]的发生, 从而避免α-FeO(OH) 出现较大团簇, 进而降低烧结后α-Fe2O3的粒径. 结果表明, 氢氧化铁胶体的搅拌条件对最终α-Fe2O3粒子晶粒尺寸有重要影响.
图 8(Fig. 8)
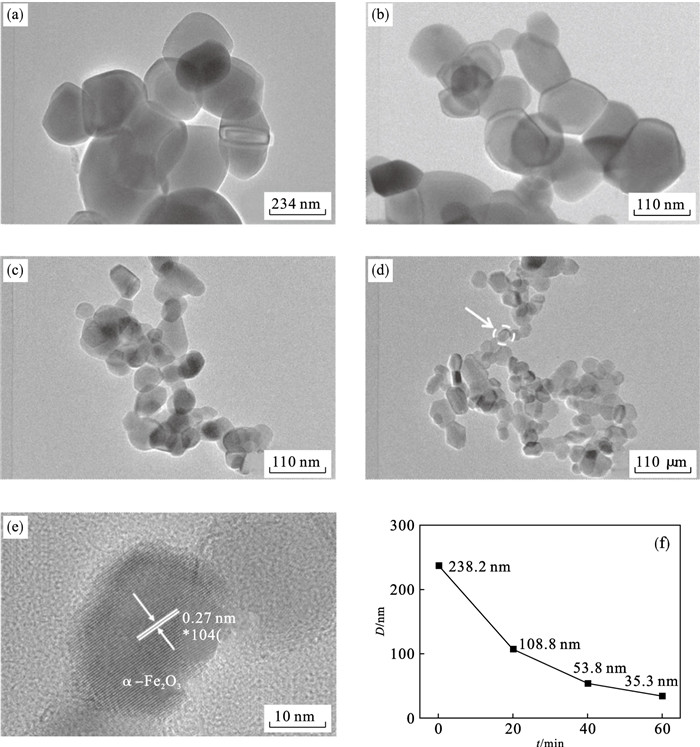 | 图 8 沉淀物经不同搅拌时间α-Fe2O3的TEM及粒径变化曲线Fig.8 TEM image and particle size change curve of α-Fe2O3 of the precipitate after different stirring time (a)—t=0 min; (b)—t=20 min; (c)—t=40 min; (d)—t=60 min; (e)—t=60 min时的高分辨TEM; (f)—不同搅拌时间下α-Fe2O3的粒径统计. |
本文制备出质量分数为99.5%、结晶度好、分散性高、平均粒径35.3 nm且矫顽力为87.3 kA/m的α-Fe2O3纳米粒子, 符合制备铁氧体元件的使用需求, 根据报道, 该品质的α-Fe2O3在光催化[26]、锂电池电极材料[27]、电磁波吸收[28]等方面具有潜在应用价值.
3 结论1) 通过设计提纯工艺, 有效去除了Mg,Ca,SO42-,Mn杂质, 并大幅降低α-Fe2O3成品中SiO2杂质. 当wNaOH为39 %时, 可使铁精粉中wSiO2降低至0.032%.
2) 烧结温度的提高会使α-Fe2O3的结晶度、微观形貌及磁性能发生变化. 随温度升高, 颗粒的结晶性逐渐变好, 但高温下颗粒形貌变得团聚烧结, 且样品的剩余磁化强度和矫顽力逐渐增加. 当烧结温度为670 ℃时, 颗粒获得最佳综合性能, 此时样品结晶度较高, 粒径均匀、晶型完整、分散性较好, 且具有亚铁磁性, 其矫顽力为87.3 kA/m.α-Fe2O3样品的wTFe为69.67%, wα-Fe2O3为99.5%.
3) 对氢氧化铁胶体沉淀物进行搅拌处理, 搅拌条件对最终形成的α-Fe2O3的晶粒尺寸有重要影响. α-Fe2O3样品的粒径随氢氧化铁胶体沉淀物搅拌时间的延长而减小, 当搅拌时间为60 min时, α-Fe2O3纳米颗粒的平均粒径仅为35.3 nm, 同时粒子具有良好结晶性和分散性.
参考文献
| [1] | Teja A S, Koh P Y. Synthesis, properties, and applications of magnetic iron oxide nanoparticles[J]. Progress in Crystal Growth and Characterization of Materials, 2009, 55(1): 22-45. |
| [2] | Zhang Z, Boxall C, Kelsall G H. Photoelectrophoresis of colloidal iron oxides 1. Hematite(α-Fe2O3)[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1993, 73: 145-163. |
| [3] | Zhang S, Ren F, Wu W, et al. Size effects of Ag nanoparticles on plasmon-induced enhancement of photocatalysis of Ag-α-Fe2O3 nanocomposites[J]. Journal of Colloid and Interface Science, 2014, 427: 29-34. DOI:10.1016/j.jcis.2013.12.012 |
| [4] | Mirzaei A, Hashemi B, Janghorban K. α-Fe2O3 based nanomaterials as gas sensors[J]. Journal of Materials Science: Materials in Electronics, 2016, 27(4): 3109-3144. DOI:10.1007/s10854-015-4200-z |
| [5] | Wang J, Shao Z B, Ru H Q. Influence of carbon sources on LiFePO4/C composites synthesized by the high-temperature high-energy ball milling method[J]. Ceramics International, 2014, 40(5): 6979-6985. DOI:10.1016/j.ceramint.2013.12.025 |
| [6] | Ruiz-Gómez M A, Rodríguez-Gattorno G, Figueroa-Torres M Z, et al. Role of assisting reagents on the synthesis of α-Fe2O3 by microwave-assisted hydrothermal reaction[J]. Journal of Materials Science: Materials in Electronics, 2021, 32(7): 9551-9566. DOI:10.1007/s10854-021-05618-x |
| [7] | Naza S, Islam M, Tabassum S, et al. Green synthesis of hematite(α-Fe2O3)nanoparticles using Rhus punjabensis extract and their biomedical prospect in pathogenic diseases and cancer[J]. Journal of Molecular Structure, 2019, 1185: 1-7. DOI:10.1016/j.molstruc.2019.02.088 |
| [8] | Hosseini-Zori M, Bondioli F, Manfredini T, et al. Effect of synthesis parameters on a hematite-silica red pigment obtained using a coprecipitation route[J]. Dyes and Pigments, 2008, 77(1): 53-58. DOI:10.1016/j.dyepig.2007.03.006 |
| [9] | Parveen S, Wani A H, Shah M A, et al. Preparation, characterization and antifungal activity of iron oxide nanoparticles[J]. Microbial Pathogenesis, 2018, 115: 287-292. DOI:10.1016/j.micpath.2017.12.068 |
| [10] | 叶学海, 刘红光, 张晓波, 等. 软磁铁氧体用高纯氧化铁红制备新工艺[J]. 化工科技市场, 2006, 29(12): 24-27. (Ye Xue-hai, Liu Hong-guang, Zhang Xiao-bo, et al. A new process of high-purity iron oxide red for soft magnetic ferrite use[J]. Chemical Technology Market, 2006, 29(12): 24-27.) |
| [11] | Paterson E. The iron oxides: structure, properties, reactions, occurrences and uses[J]. Clay Minerals, 1999, 34(1): 209-210. DOI:10.1180/claymin.1999.034.1.03 |
| [12] | Maneesha M, Doo-Man C. α-Fe2O3 as a photocatalytic material: a review[J]. Applied Catalysis A: General, 2015, 498: 126-141. DOI:10.1016/j.apcata.2015.03.023 |
| [13] | Kim K S, Yoon S Y, Lee W J, et al. Surface morphologies and electrical properties of antimony-doped tin oxide films deposited by plasma-enhanced chemical vapor deposition[J]. Surface and Coatings Technology, 2001, 138(2/3): 229-236. |
| [14] | 郭广生, 任雯, 王志华. 实验参数对激光气相法制备Fe/O粒子性能的影响[J]. 应用激光, 2002, 22(5): 491-494. (Guo Guang-sheng, Ren Wen, Wang Zhi-hua. Influence of laser synthesis parameters on the properties of Fe/O nanoparticle[J]. Applied Laser, 2002, 22(5): 491-494.) |
| [15] | Zhong L S, Hu J S, Liang H P, et al. Self-assembled 3D flowerlike iron oxide nanostructures and their application in water treatment[J]. Advanced Materials, 2006, 18(18): 2426-2431. DOI:10.1002/adma.200600504 |
| [16] | Wu M, Li H. Desulfurization of hot coal gas over regenerable low-cost Fe2O3/mesoporous Al2O3 prepared by sol-gel method[J]. Energy & Fuels, 2017, 31(2): 13921-13932. |
| [17] | Sivakumar S, Anusuya D, Khatiwada C P, et al. Characterizations of diverse mole of pure and Ni-doped α-Fe2O3 synthesized nanoparticles through chemical precipitation route[J]. Spectrochimica Acta. Part A: Molecular and Biomolecular Spectroscopy, 2014, 128: 69-75. DOI:10.1016/j.saa.2014.02.136 |
| [18] | Lassoued A, Lassoued M S, Dkhil B, et al. Synthesis, structural, morphological, optical and magnetic characterization of iron oxide(α-Fe2O3)nanoparticles by precipitation method: effect of varying the nature of precursor[J]. Physica E: Low-dimensional Systems and Nanostructures, 2018, 97: 328-334. DOI:10.1016/j.physe.2017.12.004 |
| [19] | 鲁秀国, 朱芃芃, 于兴腾. 分散剂协同化学沉淀法合成α-三氧化二铁纳米颗粒及影响因素[J]. 化工新型材料, 2021, 49(3): 135-137. (Lu Xiu-guo, Zhu Peng-peng, Yu Xing-teng. Synthesis and influence factor of α-Fe2O3 nanoparticles by precipitation method with SDS treatment[J]. New Chemical Materials, 2021, 49(3): 135-137.) |
| [20] | 杜蓉娟, 衣受志, 陈琛. 酸洗废液制备高纯氧化铁红[J]. 化工环保, 2012, 32(5): 448-451. (Du Rong-juan, Yi Shou-zhi, Chen Chen. Preparation of high-purity iron oxide red from pickling waste liquor[J]. Environmental Protection of Chemical Industry, 2012, 32(5): 448-451. DOI:10.3969/j.issn.1006-1878.2012.05.014) |
| [21] | 中国国家标准化管理委员会. GB/T 24244-2009铁氧体用氧化铁[S]. 北京: 中国标准出版社, 2009: 1-2. (Standardization Administration of the People's Republic of China. Iron oxide for ferrite: GB/T 24244-2009[S]. Beiing: Standards Press of China, 2009: 1-2. ) |
| [22] | Chen J S, Chen X, Li Y, et al. Distinct optical and magnetic properties of ionic liquid tuned hematite nanocrystals having different exposed(001)facets[J]. RSC Advances, 2014, 4(2): 593-597. DOI:10.1039/C3RA43924K |
| [23] | Yin J, Yu Z, Gao F, et al. Low-symmetry iron oxide nanocrystals bound by high-index facets[J]. Angewandte Chemie, 2010, 122(36): 6472-6476. DOI:10.1002/ange.201002557 |
| [24] | Myerson A S. Handbook of industrial crystallization[M]. Oxford: Butterworth Heinemann Press, 2002: 46-50. |
| [25] | Nore P, Mersmann A. Batch precipitation of barium carbonate[J]. Chemical Engineering Science, 1993, 48(17): 3083-3088. DOI:10.1016/0009-2509(93)80174-O |
| [26] | Prawit N, Paweena P, Saksit C, et al. Enhanced photocatalytic degradation of methylene blue using Fe2O3/graphene/CuO nanocomposites under visible light[J]. Journal of Environmental Chemical Engineering, 2019, 7(6): 103438. DOI:10.1016/j.jece.2019.103438 |
| [27] | Li J, Wang N, Deng J, et al. Flexible metal-templated fabrication of mesoporous on ion-like carbon and Fe2O3@N-doped carbon foam for electrochemical energy storage[J]. Journal of Materials Chemistry A, 2018, 6(27): 13012-13020. DOI:10.1039/C8TA02417K |
| [28] | Wu H J, Wu G L, Wang L D. Peculiar porous α-Fe2O3, γ-Fe2O3 and Fe3O4 nanospheres: facile synthesis and electromagnetic properties[J]. Powder Technology, 2015, 269: 443-451. DOI:10.1016/j.powtec.2014.09.045 |
