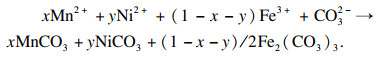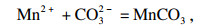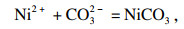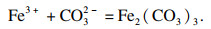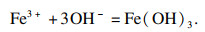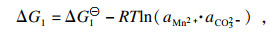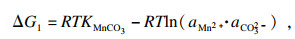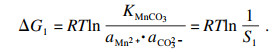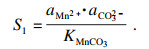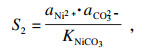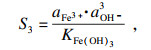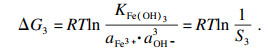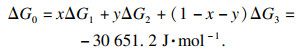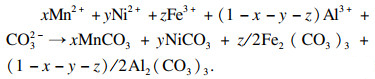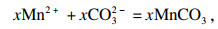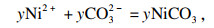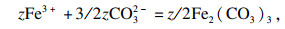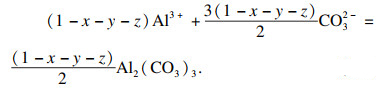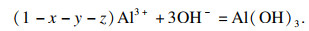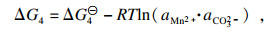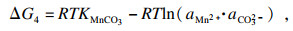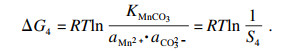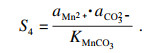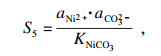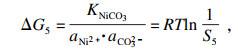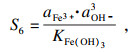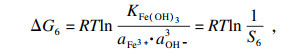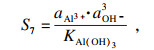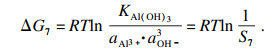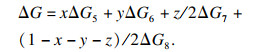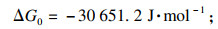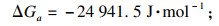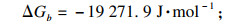赵赫
1,2, 高宣雯
1,2, 李建中
1,2

, 丁学勇
2 1. 东北大学 多金属共生矿生态化冶金教育部重点实验室, 辽宁 沈阳 110819;
2. 东北大学 冶金学院, 辽宁 沈阳 110819
收稿日期:2021-07-26
基金项目:国家重点研发计划项目(2019YFE0123900);国家自然科学基金资助项目(51974069)。
作者简介:赵赫(1993-),男,河南许昌人,东北大学博士研究生;
李建中(1976-),男,辽宁沈阳人,东北大学教授,博士生导师。
摘要:以共沉淀法制备钠离子层状氧化物正极材料NaNi
0.4Mn
0.4Fe
0.2O
2, 采用Al
3+有效控制和平衡共沉淀反应的过程.考察了加入Al元素带来的热力学耦合效应及对正极材料电化学性能的影响.结果表明, 在Mn
2+, Ni
2+和Fe
2+离子共存的环境中, 由于Al
3+更高的过饱和度和更负的吉布斯自由能变(Δ
G)所产生的热力学耦合效应, 显著改变了溶液离子之间的沉淀驱动力, 加速Ni
2+和Mn
2+的沉淀并抑制Fe
3+的沉淀.Na[Ni
0.4Mn
0.4Fe
0.2]
0.995Al
0.005O
2正极材料表现出优异的电化学性能, 这归因于引入Al
3+制备得到高质量的前驱体([0.4MnCO
3 · 0.4NiCO
3 · 0.2Fe(OH)
3]
0.995 · 0.005Al(OH)
3).
关键词:耦合效应层状氧化物钠离子电池共沉淀前驱体
Coupling Effects of Thermodynamics in Co-precipitation on Electrochemical Performance of Cathode Materials
ZHAO He
1,2, GAO Xuan-wen
1,2, LI Jian-zhong
1,2

, DING Xue-yong
2 1. Key Laboratory for Ecological Metallurgy of Multimetallic Ores, Ministry of Education, Northeastern University, Shenyang 110819, China;
2. School of Metallurgy, Northeastern University, Shenyang 110819, China
Corresponding author: LI Jian-zhong, E-mail:
lijz@smm.neu.edu.cn.
Abstract: The sodium ion layered oxide cathode material NaNi
0.4Mn
0.4Fe
0.2O
2 was synthesized by the co-precipitation method, and Al
3+was used to effectively control and balance the co-precipitation reaction process. The thermodynamic coupling effect brought by the addition of Al element and its influence on electrochemical performance of cathode materials were investigated. In an environment where Mn
2+, Ni
2+ and Fe
3+ ions coexist, owing to the thermodynamic coupling effect, the superior high supersaturation of Al
3+ and the more negative change in the Gibbs free energy(Δ
G)can efficiently changes the precipitation driving force between the solution ions, accelerating the precipitation of Ni
2+and Mn
2+ ions and inhibiting the precipitation of Fe
3+ ions. The obtained Na[Ni
0.4Mn
0.4Fe
0.2]
0.995Al
0.005O
2 cathode material has demonstrated excellent electrochemical performance which can be attributed to the high quality precursor([0.4MnCO
3 ·0.4NiCO
3 · 0.2Fe(OH)
3]
0.995 · 0.005Al(OH)
3) brought about by the introduction of Al
3+.
Key words: coupling effectslayered oxidesodium ion batteryco-precipitationprecursor
随着锂离子动力电池新能源汽车的高速发展, 锂元素较低的储量和较高的成本引发了人们对锂离子电池发展问题的担忧
[1-5].O3-NaNi
0.4Mn
0.4Fe
0.2O
2由于较高的实际容量(2.0~4.0 V充电时, 充电比容量大于120 mAh · g
-1)以及较低的成本, 被认为是最有潜力替代锂离子二次电池的储钠正极材料
[5].钠离子电池正极材料与锂离子电池正极材料制备的共沉淀工艺相似, 通过改变不同的参数, 如pH、反应温度和时间, 以及初始溶液和材料的浓度, 可以准确地优化和实现所需的最终产品
[6].在Mn
2+, Ni
2+和Fe
2+离子共存的环境中, 共沉淀过程的理论基于水溶液热力学的类型, 并与物质在水溶液中的稳定性密切相关.这种稳定性决定了液相中的结晶反应与溶液中的物质组成、pH、浓度、温度和压力密切相关
[7-11].此外, 粒径、形态可能进一步受多种因素的影响, 包括液相中的离子与沉积的结晶材料之间的沉淀结晶反应、吸附反应以及多个反应之间的热力学耦合.随着晶粒的逐渐长大和新的晶核不断出现, 共存现象导致结晶反应和吸附反应之间的竞争
[12-13].随着水溶液中离子浓度的变化形成饱和溶液, 从而形成晶体, 该过程可视为吉布斯自由能变(Δ
G)减少的过程.热力学耦合会伴随并发生在多种离子共存的环境中, 如果一个或多个分量的吉布斯自由能变(Δ
G)非常优于其他分量, 则吉布斯自由能变(Δ
G)的组成会受到影响, 例如加速某个分量的沉淀
[14-15]. 因此, 本文基于热力学耦合、多离子共存和过饱和, 探索了吉布斯自由能变(Δ
G)和耦合系数.采用铝离子掺杂来控制共沉淀过程并平衡沉淀驱动力以同时实现多个离子结晶反应.为共沉淀工艺生产和优化钠离子电池正极材料NaNi
0.4Mn
0.4Fe
0.2O
2提供理论支撑.
1 实验1.1 前驱体和正极材料的合成通过共沉淀过程合成了各种前驱体.将化学计量比(Ni+Mn+Fe∶ Al=1-
x∶
x)的Ni(CH
3COO)
2 · 4H
2O(>99 %), Mn(CH
3COO)
2 · 4H
2O(>99 %), Fe(NO)
3 · 9H
2O(>99 %)和Al(NO)
3 · 9H
2O(>99 %)均匀混合并溶解在去离子水中.然后将该混合金属溶液泵入连续搅拌的罐式反应器中.同时, 将作为沉淀剂的Na
2CO
3溶液和作为pH控制剂的NH
4OH溶液在空气气氛中分别加入反应器中.在整个共沉淀过程中严格控制混合溶液的温度、pH值和搅拌速度.然后, 将所得粉末过滤、洗涤并在120 ℃下干燥获得前驱体.最后, 将获得的前驱体与所需的Na
2CO
3充分混合, 并在900 ℃下空气气氛中煅烧10 h.其中, Na
2CO
3的计量比过量5 % 用于补偿煅烧过程中Na的损失.
通过控制Al(NO)
3 · 9H
2O的用量合成不同掺杂量的样品, 标记为Na[Ni
0.4Mn
0.4Fe
0.2]
1-xAl
xO
2(
x=0, 0.002 5, 0.005, 0.01).
1.2 材料表征使用具有非单色化Cu Ka靶材作为X射线源的布鲁克D8-advance衍射仪进行XRD测量以研究晶体结构.测试过程中管电压为40 kV, 管电流为200 mA.使用日立JSM-7500场发射扫描电子显微镜检查样品的形态.使用BT-9300ST型激光粒度分布仪进行前驱体的粒度分布研究.
1.3 电化学性能测试电化学性能通过使用组装在充满氩气的手套箱中的CR2025型纽扣电池进行测试.在N-甲基-2-吡咯烷酮中混合活性材料、乙炔黑和聚偏二氟乙烯PVDF(质量比为8∶ 1∶ 1)形成浆料, 并将浆料涂覆在铝箔上来制备正极极片.正极极片在110 ℃下真空干燥12 h.正极极片活性物质的质量负载在1.2~1.5 mg · cm
-2范围内.电解质是1 mol NaClO
4溶解在体积比为1∶ 1的碳酸亚乙酯(EC)/碳酸二甲酯(DMC)中.半电池的负极为金属钠, 隔膜为Whatman GF-D玻璃纤维素滤纸.恒电流充放电测试使用武汉蓝电LAND CT2001A型多通道电池测试系统.循环伏安测试(CV)和交流阻抗测试(EIS)采用普林斯顿2273A电化学工作站.
2 结果与讨论2.1 Mn
2+, Ni
2+和Fe
3+共沉淀过程中的热力学耦合效应在恒温恒压条件下的析出过程中, Mn
2+, Ni
2+, Fe
3+的结晶过程可视为吉布斯自由能变(Δ
G)减少的过程.当使用Na
2CO
3同时沉淀Mn
2+,Ni
2+和Fe
2+时, 可发生以下反应:
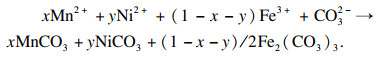 | (1) |
整个析出过程可以分为以下反应:
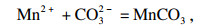 | (2) |
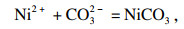 | (3) |
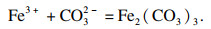 | (4) |
水溶液中碳酸铁是不存在的, 因为一旦碳酸铁在水中形成复分解反应, 碳酸盐与铁离子会发生双重水解, 大量氢离子与羟基铁生成氢氧化铁、碳酸根离子和水.在水溶液中, Fe
3+倾向于生成氢氧化铁, 其溶度积常数为1.1×10
-36, 并发生以下反应:
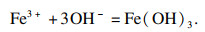 | (5) |
相应的热力学行为可以使用吉布斯自由能变(Δ
G)和反应温度(
T)来描述.以MnCO
3作为单独的沉淀过程为例, 在沉淀反应的早期阶段, 热力学参数可根据式(6)~(8)计算:
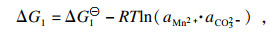 | (6) |
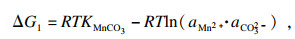 | (7) |
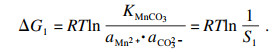 | (8) |
碳酸锰的过饱和度可表示为
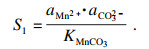 | (9) |
同样, 对于NiCO
3和Fe
2(CO
3)
3的相应过程, 过饱和度和Δ
G可以表示为
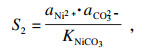 | (10) |
 | (11) |
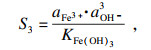 | (12) |
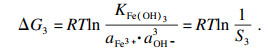 | (13) |
相应的沉淀参数可以根据
表 1中汇总的数据, 根据式(6)~(13)计算和确认.对应的值分别为
S1=3.68×10
4,
S2=141.8,
S3= 2.6×10
13.Δ
G1=-26 060.1 J · mol
-1, Δ
G2=-12 281.4 J · mol
-1, Δ
G3=-76 572.9 J · mol
-1.
表 1(Table 1)
 表 1 不同样品上清液离子浓度Table 1 Ion concentrations of differentliquid supernatant ? 表 1 不同样品上清液离子浓度Table 1 Ion concentrations of differentliquid supernatant ? | mol · L-1 | | x | Mn2+ | Ni2+ | Fe3+ | Al3+ | NO3- | OH- | CO32- | | 0 | 4.57×10-5 | 6.713×10-5 | 2.865×10-5 | 0 | 0.087 9 | 7.94×10-7 | 0.006 3 | | 0.002 5 | 2.37×10-6 | 1.005×10-5 | 7.162×10-6 | 1.482×10-6 | 0.089 35 | 1.41×10-6 | 0.018 9 | | 0.005 | 2.73×10-7 | 6.645×10-6 | 7.162×10-6 | 5.189×10-6 | 0.082 42 | 8.93×10-7 | 0.011 7 | | 0.01 | 2.91×10-6 | 7.156×10-6 | 7.699×10-6 | 2.076×10-5 | 0.097 9 | 1×10-6 | 0.031 |
| 表 1 不同样品上清液离子浓度 Table 1 Ion concentrations of differentliquid supernatant ? |
在式(14)中,
x=0.4,
y=0.4:
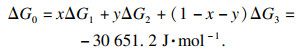 | (14) |
Δ
G0 < 0表明结晶反应可以自发进行.可以得出结论, 当多种离子共存时, FeCO
3沉淀反应的驱动力远强于MnCO
3, 其次NiCO
3.
2.2 Al
3+添加引起的热力耦合效应在恒温恒压共沉淀反应体系中, 由Na
2CO
3,Mn(CH
3COO)
2,Ni(CH
3COO)
2,Fe(NO
3)
3和Al(NO
3)
3结晶生成的前驱体为
xMnCO
3 ·
yNiCO
3 ·
z/2Fe
2(CO
3)
3 · (1-
x-
y-
z)/2Al
2(CO
3)
3, 以生成1 mol前驱体为例, 反应为
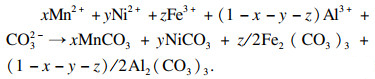 | (15) |
式(15)可分为以下单独的沉淀反应:
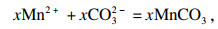 | (16) |
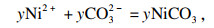 | (17) |
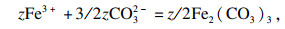 | (18) |
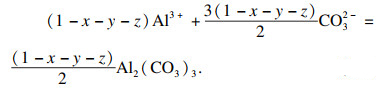 | (19) |
与Fe
2(CO
3)
3相似, Al
2(CO
3)
3不能存在于水中, 并会像式(20)中那样产生Al(OH)
3, 其溶度积常数为3×10
-34.
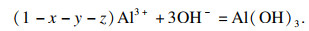 | (20) |
理论上单独的碳酸盐或氢氧化物的沉淀过程热力学行为可以使用吉布斯自由能变(Δ
G)和反应温度(
T)来描述.以MnCO
3沉淀过程为例, 在沉淀反应的早期阶段, 热力学参数可以根据式(21)~(24)计算:
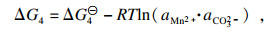 | (21) |
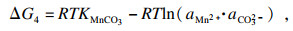 | (22) |
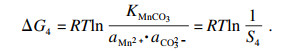 | (23) |
碳酸锰的过饱和度可表示为
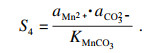 | (24) |
类似地, 对于NiCO
3, Fe(OH)
3和Al(OH)
3的相应过程, 过饱和度和吉布斯自由能变可以表示为
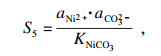 | (25) |
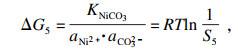 | (26) |
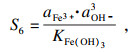 | (27) |
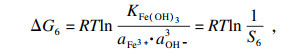 | (28) |
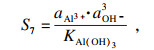 | (29) |
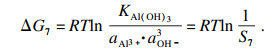 | (30) |
经过化学分析和计算, Al添加量从
x=0增加到
x=0.002 5, 0.005和0.01时共沉淀反应完全后上清液中各种元素的浓度汇总在
表 1中.反应过程中相应的离子过饱和度(
S)和Δ
G值可以分别表示为
S0,
Sa,
Sb,
Sc和Δ
G0, Δ
Ga, Δ
Gb, Δ
Gc.所有数据均根据上述式计算得出, 分别汇总在
表 2和
表 3中.
表 2(Table 2)
 表 2 溶液中离子的过饱和度Table 2 The degree of supersaturation of ion in the solution 表 2 溶液中离子的过饱和度Table 2 The degree of supersaturation of ion in the solution | 过饱和度 | Mn2+ | Ni2+ | Fe3+ | Al3+ | | S0 | 36 794.3 | 141.8 | 2.60×1013 | 0 | | Sa | 1 755.6 | 20.33 | 4.64×1012 | 3.52×1010 | | Sb | 28.17 | 1.87 | 1.83×1013 | 4.85×1010 | | Sc | 1 590.5 | 10.67 | 3.50×1012 | 3.46×1010 |
| 表 2 溶液中离子的过饱和度 Table 2 The degree of supersaturation of ion in the solution |
表 3(Table 3)
 表 3 共沉淀过程中的吉布斯自由能变(ΔG)Table 3 The Gibbs free energy(ΔG)change in the co-precipitation ? 表 3 共沉淀过程中的吉布斯自由能变(ΔG)Table 3 The Gibbs free energy(ΔG)change in the co-precipitation ? | J · mol-1 | | ΔG | MnCO3 | NiCO3 | Fe(OH)3 | Al(OH)3 | | ΔG0 | -26 060.1 | -12 281.4 | -76 572.9 | 0 | | ΔGa | -18 518.1 | -7 467.3 | -72 294.7 | -60 194.9 | | ΔGb | -8 266.6 | -1 543.3 | -75 691.4 | -60 990.2 | | ΔGc | -18 273.4 | -5 867.7 | -71 600.2 | -60 156.6 |
| 表 3 共沉淀过程中的吉布斯自由能变(ΔG) Table 3 The Gibbs free energy(ΔG)change in the co-precipitation ? |
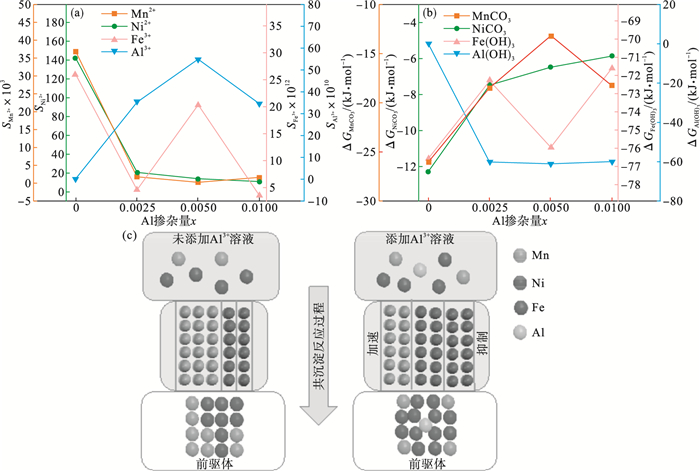
离子过饱和度(
S)和Δ
G值的变化趋势如
图 1所描述.从
图 1a和
1b可以看出, Al
3+的过饱和度随着Al
3+添加量的增加呈现出先增大后减小的趋势, 而当Al
3+从
x=0.002 5到
x=0.01时, Al
3+的Δ
G表现出相反的趋势.同时, 即使添加少量的Al
3+, Mn
2+和Ni
2+的过饱和度(
S)和Δ
G值也会发生剧烈变化.如
图 1c沉淀过程示意图所示, 由于热力学耦合效应, Al
3+更高的过饱和度和更负的Δ
G代表了加速Ni
2+和Mn
2+沉淀的驱动力.同时, 由于Al(OH)
3晶种的优先形成和在溶液中良好的吸附能力, 溶液中的Ni
2+和Mn
2+可以被吸附并在Al(OH)
3表面生长而完全沉淀.另一方面, Fe
3+的沉淀行为与Ni
2+和Mn
2+的沉淀行为相反.当Al
3+添加量为0.005时, 各元素的热力学行为达到相对一致的程度, 从而同时共沉淀.因此, 可以得出结论, 即使少量的Al
3+掺杂也会显著影响Ni
2+,Mn
2+和Fe
2+的沉淀.通过添加Al
3+产生的热力学耦合效应, 可以通过加速或抑制来平衡和实现不同元素的析出一致性.
图 1(Fig. 1)
生成1 mol前驱体反应的Δ
G为
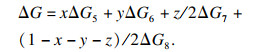 | (31) |
当未添加Al
3+时, 对应的结果为
当Al
3+添加量为
x=0.002 5时, 则有
当Al
3+添加量为
x=0.005时, 则有
当Al
3+添加量为
x=0.01时, 则有
由于Δ
G0 < Δ
Ga < Δ
Gc < Δ
Gb < 0, 可以认为Al
3+对整个共沉淀反应有一定的促进作用, 当Al
3+添加量为
x=0.005时, 促进作用最大.然而, 随着Al含量的增加, Mn
2+和Ni
2+的析出会略有增加, 并且在
x达到0.005之前, Fe
3+的析出也有所增加.
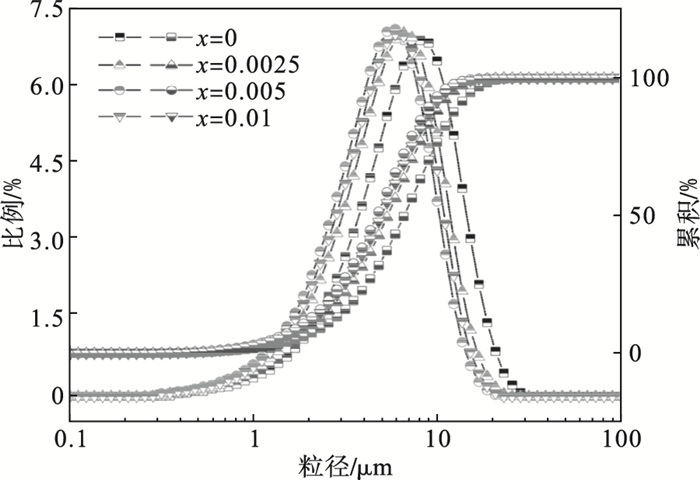
前驱体的粒度分布可以通过在激光粒度分布仪的辅助下进行研究, 如
图 2所示.
图 2(Fig. 2)
与热力学计算的结果一样, Al
3+的添加可以显著影响前驱体中粒度的分布.通过优化Al
3+的添加量, 粒度分布的均匀度也会发生变化.当Al
3+添加量
x从0增加到0.005时, 不同粒度的分布呈正趋势, 而当Al
3+添加量
x高达0.01时则呈负向分布.
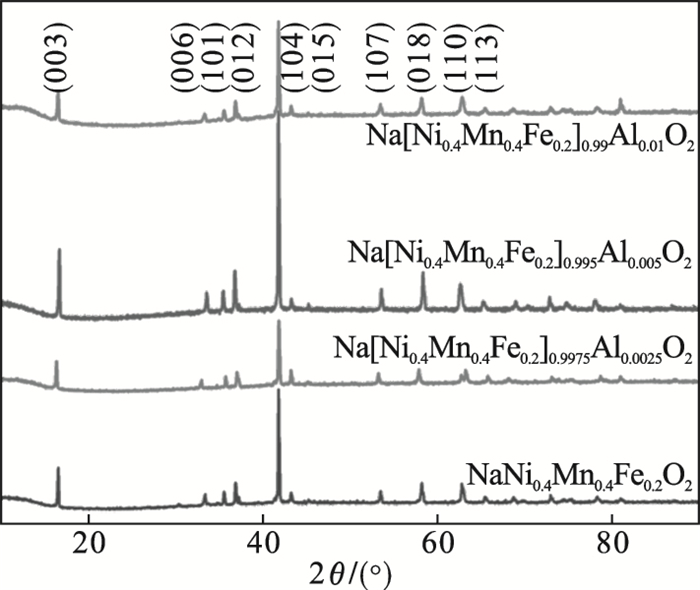
2.3 正极材料相结构与形貌分析层状钠离子电池正极材料由制备的前驱体和对应的Na
2CO
3高温焙烧合成.如
图 3中的X射线衍射(XRD)图谱所示, 所有最终的Na[Ni
0.4Mn
0.4Fe
0.2]
1-xAl
xO
2(
x=0, 0.002 5, 0.005, 0.01)样品都显示出具有R3 - m空间群的α-NaFeO
2层状结构
[16].正极材料XRD衍射峰的三强峰分别对应晶体的(003),(104)和(012)晶面.除了α-NaFeO
2相结构的衍射峰以外, 所有样品在42°左右的位置观察到NiO杂质相的衍射峰.此外随着Al掺杂量不断增加, 制备的正极材料的衍射峰位置基本没有变化, 表明Al掺杂对材料的相结构与组成成分没有明显影响.同时, 当Al掺杂量
x=0.005时, 制备的正极材料的衍射峰强度最强, 这是由于形成的前驱体具有更小的粒径, 从而所获的正极材料具有较小的粒径.
图 3(Fig. 3)
图 4为Al掺杂的Na[Ni
0.4Mn
0.4Fe
0.2]
1-xAl
xO
2(
x=0, 0.002 5, 0.005, 0.01)样品的SEM图像.从
图 4a中可以看出, 未掺杂样品表现出不规则的形貌, 粒径分布不均一且出现较严重的团聚, 其粒径范围在0.3~1 μm之间.在掺杂后样品中, 材料的形貌趋近于八面体特征, 如
图 4b~
4d所示.其中, Al掺杂量
x=0.005时, 样品的SEM照片显示出相对较为均匀的粒径分布, 其平均颗粒尺寸为0.2 μm, 初级晶体的表面光滑且完整, 并具有更完整的层状正极材料单晶体的八面体特征.对于钠离子电池的正极材料, 这种结构有助于电解液的渗透和加速反应动力学
[17].
图 4(Fig. 4)
2.4 正极材料电化学性能分析
图 5是Na[Ni
0.4Mn
0.4Fe
0.2]
1-xAl
xO
2(
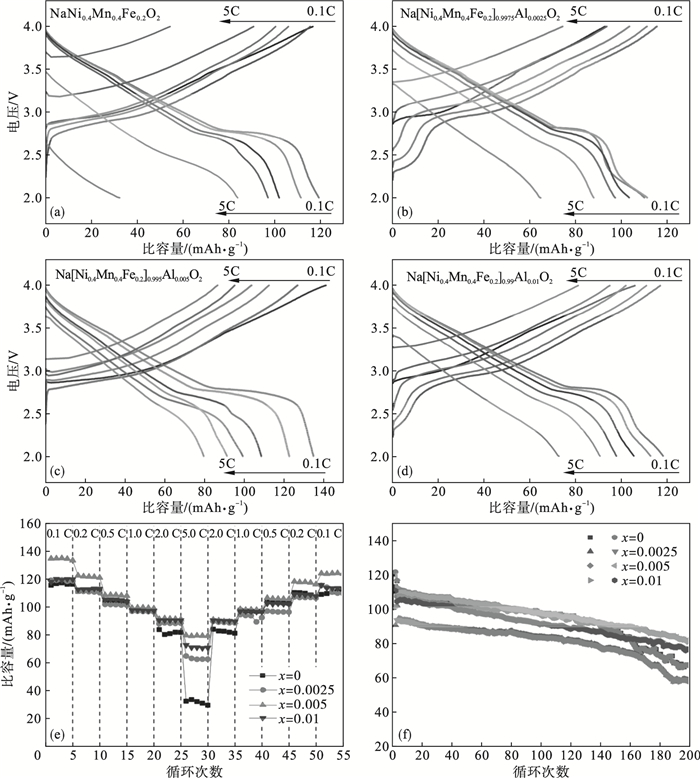
x=0, 0.002 5, 0.005和0.01)样品的充放电测试.
图 5a~
图 5d显示了不同Al掺杂量样品在2.0~4.0 V电压范围内不同倍率下的初始充放电曲线.其中, Na[Ni
0.4Mn
0.4Fe
0.2]
0.995Al
0.005O
2在3.5 V左右具有典型的电压平台, 这可归因于它的两相反应.该材料在0.1C, 0.2C, 0.5C, 1.0C, 2.0C和5.0C下的放电容量分别为135.1,122.9,108.8,99.5,91.5和79.8 mAh · g
-1.
图 5e显示了不同Al掺杂量正极材料的倍率性能.结果表明, Al
3+掺杂对Na[Ni
0.4Mn
0.4Fe
0.2]
1-xAl
xO
2样品在不同充放电速率下的放电比容量具有显著影响.这是因为Al元素的引入使得Na[Ni
0.4Mn
0.4Fe
0.2]
0.995Al
0.005O
2样品的性质发生变化, 例如具有均匀的粒径分布, 杂质相减少和较大的表面积, 导致更多的反应位点和在氧化还原中的反应过程更短的钠离子快速扩散距离.
图 5f为各个样品在0.5C倍率下的循环性能.与纯样品相比, Al掺杂材料表现出明显更稳定的循环性能.
图 5(Fig. 5)
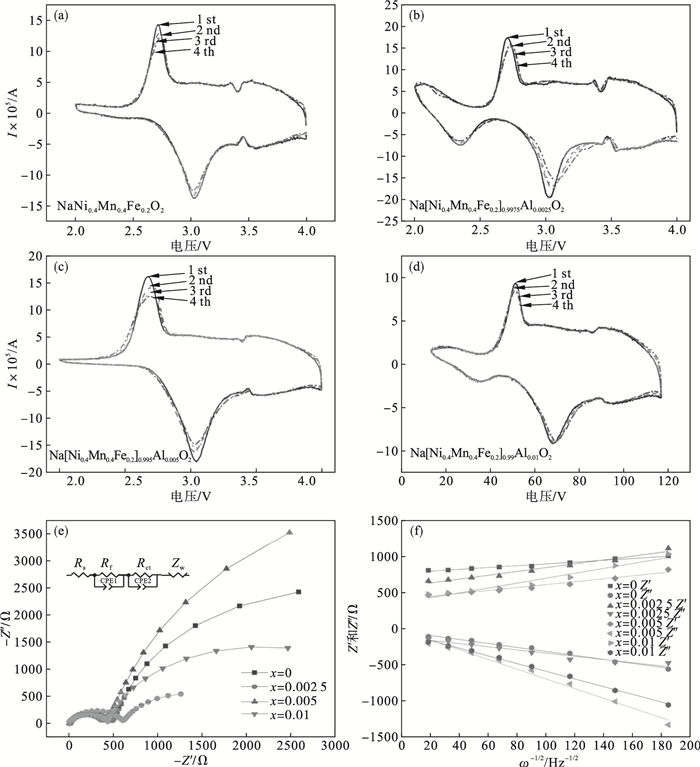
图 6是对各种样品进行的循环伏安测试和交流阻抗测试.如
图 6a~
图 6d所示, 在2.0~4.0 V电压范围内0.1 mV · s
-1扫描速率下的循环伏安图中, 所有样品均呈现标准的层状氧化物谱图, 其中3.4 V左右存在的氧化还原峰与NiO相有关.然而, 与未掺杂的NaNi
0.4Mn
0.4Fe
0.2O
2样品相比, Al掺杂的样品具有更宽的电压平台和更小的极化, 表明掺杂样品具有更好的反应动力学.Na[Ni
0.4Mn
0.4Fe
0.2]
1-xAl
xO
2材料的电化学阻抗谱如
图 6e所示.所有的EIS测试是在对每个电池进行完整的循环伏安法测试后进行的.所有样品的阻抗谱类似, 高频时有一个电容回路, 低频区与Warburg阻抗(
Zw)相关.感抗电阻(
Rf)和具有非理想电容器(CPE1)的恒定相位元件对应于高频区半圆.电荷转移电阻(
Rct)和具有非理想电容器(CPE2)的恒定相位元件对应于低频区半圆, 阻抗曲线与
Z′轴的交点与电极和电解质的电阻(
Rs)相关
[18].同时, 钠离子的扩散系数(
DNa)用公式(32)和(33)
[19-20]计算:
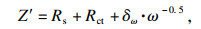 | (32) |
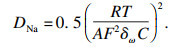 | (33) |
图 6(Fig. 6)
其中:
ω为频率; Warburg阻抗系数(
δω)由
Z′-
ω-0.5的线性拟合获得, 如
图 6f所示;
R为理想气体常数;
F(C · mol
-1)为法拉第常数;
T(K)为绝对温度;
A(cm
2)为活性材料的表面积;
C(mol · cm
-3)为与钠嵌入状态相关的活性电极材料中Na
+的密度.
从等效电路计算的阻抗值如
表 4所示, 较低的电荷转移电阻显著增强了电子导电性和电荷转移过程.这表明Al
3+掺杂样品在Na
+扩散的迁移率方面表现出明显的改善.Al掺杂对层状钠正极材料中的电子电导率和晶格结构的变化具有积极的影响.从电荷转移电阻值的变化可以看出, Al
3+掺杂材料的电子传导激活能较低, 进而提升材料的电子电导率.电子电导率的提高有助于提高层状钠离子正极材料的电化学性能
[21].
表 4(Table 4)
 表 4 通过等效电路计算Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2的阻抗参数Table 4 Impedance parameters for Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2 表 4 通过等效电路计算Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2的阻抗参数Table 4 Impedance parameters for Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2 | x | Rs | CPE | Rf | CPE | Rct | W | DNa | | 0 | 3.983 | 4.573×10-3 | 4.088×103 | 6.505×10-6 | 4.573×102 | 7.534×10-4 | 2.67×10-12 | | 0.002 5 | 6.306 | 7.268×10-6 | 6.022×102 | 3.324×10-3 | 1.495×103 | 6.863×10-5 | 3.38×10-13 | | 0.005 | 3.640 | 3.899×10-3 | 7.859×104 | 6.908×10-6 | 3.692×102 | 5.129×10-3 | 1.48×10-11 | | 0.01 | 4.587 | 2.590×10-3 | 3.494×103 | 8.304×10-5 | 4.320×102 | 4.652×10-4 | 5.96×10-12 |
| 表 4 通过等效电路计算Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2的阻抗参数 Table 4 Impedance parameters for Na[Ni0.4Mn0.4Fe0.2]1-xAlxO2 |
3 结论1) 基于热力学计算, 当多种离子共存于液体溶液中并同时发生结晶反应时, 会发生耦合效应.
2) 尽管各种元素的沉淀结晶驱动力不同, 但由于Al
3+更高的过饱和度和少量Al
3+添加带来的更负的吉布斯自由能变(ΔG), 耦合效应可以有效地控制和平衡共沉淀过程, 加速共沉淀过程.
3) Al
3+的引入促进Ni
2+和Mn
2+的沉淀并抑制Fe
3+的沉淀.当Al
3+的添加量为
x=0.005时, 得到的前驱体粒径分布均匀, 制备的正极材料表现出更好的电化学性能, 为开发高性能钠离子电池正极材料铺平道路.
参考文献 | [1] | Zhang J, Cheng F, Chou S, et al. Tuning oxygen redox chemistry in Li-rich Mn-based layered oxide cathodes by modulating cation arrangement[J]. Advanced Materials, 2019, 31(9): 1901808.
|
| [2] | Sun Y, Guo S, Zhou H. Exploration of advanced electrode materials for rechargeable sodium-ion batteries[J]. Advanced Energy Materials, 2018, 9(1): 1800212.
|
| [3] | Eftekhari A, Kim D W. Sodium-ion batteries: new opportunities beyond energy storage bylithium[J]. Journal of Power Sources, 2018, 395(6): 336-348.
|
| [4] | Liang Y, Li S, Xie J, et al. Synthesis and electrochemical characterization of Mg-Al co-doped Li-rich Mn-based cathode materials[J]. New Journal of Chemistry, 2019, 43(11): 12004-12012.
|
| [5] | Delmas C. Sodium and sodium-ion batteries: 50 years of research[J]. Advanced Energy Materials, 2018, 8(2): 1703137.
|
| [6] | Liang Y, Lai W H, Miao Z, et al. Nanocomposite materials for the sodium-ion battery: a review[J]. Small, 2018, 14(9): 1702514.
|
| [7] | Nayak P K, Grinblat J, Levi M, et al. Al doping for mitigating the capacity fading and voltage decay of layered Li and Mn-rich cathodes for Li-ion batteries[J]. Advanced Energy Materials, 2016, 6(7): 1502398.
|
| [8] | Ye H, Wang C Y, Wang P F, et al. Realizing a highly stable sodium battery with dendrite-free sodium metal composite anodes and O3-type cathodes[J]. Nano Energy, 2018, 48(5): 369-376.
|
| [9] | Hu H, Bai Y S, Miao C Q, et al. Polyfurfuryl alcohol assisted synthesis of Na2FePO4F/C nanocomposites as cathode material of sodium ion batteries[J]. Journal of Electroanalytical Chemistry, 2020, 867(12): 114187.
|
| [10] | Song H J, Kim K H, Kim J C, et al. Superior sodium storage performance of reduced graphene oxide supported Na3.12Fe2.44(P2O7)2/C nanocomposites[J]. Chemical Communications, 2017, 53(5): 9316-9319.
|
| [11] | Wang W L, Gang Y, Hu Z, et al. Reversible structural evolution of sodium-rich rhombohedral Prussian blue for sodium-ion batteries[J]. Nature Communications, 2020, 11: 980-988. DOI:10.1038/s41467-020-14444-4
|
| [12] | Jeong S, Kim B H, Park Y D, et al. Artificially coated NaFePO4 for aqueous rechargeable sodium-ion batteries[J]. Journal of Alloys and Compounds, 2019, 784(3): 720-726.
|
| [13] | Ma A, Yin Z, Wang J, et al. Al-doped NaNi1/3Mn1/3Fe1/3O2 for high performance of sodium ion batteries[J]. Ionics, 2020, 26(6): 1797-1804.
|
| [14] | Sun Y K, Chen Z, Noh H J, et al. Nanostructured high-energy cathode materials for advanced lithium batteries[J]. Nature Materials, 2012, 11(2): 942-947.
|
| [15] | Chen H, Feng P, Ye S X, et al. The coupling effect of calcium concentration and pH on early hydration of cement[J]. Construction and Building Materials, 2018, 185: 391-401. DOI:10.1016/j.conbuildmat.2018.07.067
|
| [16] | Yabuuchi N, Yano M, Yoshida H, et al. Synthesis and electrode performance of O3-type NaFeO2-NaNi1/2Mn1/2O2 solid solution for rechargeable sodium batteries[J]. Journal of The Electrochemical Society, 2013, 160(9): A3131-A3137.
|
| [17] | Kim D H, Lee E J, Slater M, et al. Layered Na[Ni1/3Fe1/3Mn1/3]O2 cathodes for Na-ion battery application[J]. Electrochemistry Communications, 2012, 18(1): 66-69.
|
| [18] | Mao J, Liu X, Liu J, et al. P2-type Na2/3Ni1/3Mn2/3O2 cathode material with excellent rate and cycling performance for sodium-ion batteries[J]. Journal of The Electrochemical Society, 2019, 166: A3980-A3986. DOI:10.1149/2.0211916jes
|
| [19] | Han M H, Gonzalo E, Sharma N, et al. High-performance P2-phase Na2/3Mn0.8Fe0.1Ti0.1O2 cathode material for ambient-temperature sodium-ion batteries[J]. Chemistry of Materials, 2015, 28: 106-116.
|
| [20] | Luo R, Wu F, Xie M, et al. Habit plane-driven P2-type manganese-based layered oxide as long cycling cathode for Na-ion batteries[J]. Journal of Power Sources, 2018, 383: 80-86. DOI:10.1016/j.jpowsour.2018.02.053
|
| [21] | Wang P F, You Y, Yin Y X, et al. An O3-type NaNi0.5Mn0.5O2 cathode for sodium-ion batteries with improved rate performance and cycling stability[J]. Journal of Materials Chemistry A, 2016, 4: 17660-17664. DOI:10.1039/C6TA07589D
|

 , 丁学勇2
, 丁学勇2 
 , DING Xue-yong2
, DING Xue-yong2