
 , 汤军舰, 刘振宇
, 汤军舰, 刘振宇 东北大学 轧制技术及连轧自动化国家重点实验室, 辽宁 沈阳 110819
收稿日期:2020-10-23
基金项目:国家重点研发计划项目(2017YFB0304104, 2017YFB0305002); 国家自然科学基金资助项目(U1660117); 中央高校基本科研业务费专项资金资助项目(N180704008)。
作者简介:王皓(1993-), 男, 辽宁铁岭人, 东北大学博士研究生;
刘振宇(1967-), 男, 内蒙古赤峰人, 东北大学教授, 博士生导师。
摘要:采用高温同步热分析仪(TGA) 对高强钢的高温氧化行为进行了系统研究,分析了不同相对湿度条件下氧化质量变化规律,并采用场发射电子探针(EPMA) 表征氧化铁皮厚度、截面形貌及元素分布,同时采用X射线衍射(XRD) 分析氧化层的物相组成.实验结果表明,在1 000 ℃的不同相对湿度条件下,氧化质量变化曲线由线性规律转变为抛物线规律时,曲线出现明显的拐点,拐点处对应的氧化层质量随相对湿度的升高而增加;潮湿气氛促进氧化铁皮内部产生大量的孔洞和微裂纹等缺陷,这些缺陷成为离子扩散通道从而加快氧化反应;水蒸气能促进Si和Mn元素扩散,导致元素富集层扩大.
关键词:高强钢水蒸气高温氧化氧化动力学氧化铁皮
High Temperature Oxidation Behavior of 700 MPa Grade High Strength Steel Under Water Vapor Condition
WANG Hao, CAO Guang-ming

 , TANG Jun-jian, LIU Zhen-yu
, TANG Jun-jian, LIU Zhen-yu State Key Laboratory of Rolling and Automation, Northeastern University, Shenyang 110819, China
Corresponding author: CAO Guang-ming, E-mail: caogm@ral.neu.edu.cn.
Abstract: High temperature oxidation behavior of high strength steel was systematically studied by high-temperature thermal gravimetric analyzer(TGA) and the law of oxidation weight gain under different relative humidity conditions was analyzed. Electron probe microanalysis(EPMA) was used to characterize the thickness, cross-sectional morphologies and element distribution of oxide scale and X-ray diffraction(XRD) was used to analyze the phase composition of oxide layer. The experimental results show that the form of weight gain curves transformed from linear law to parabolic law, the curves showed an obvious turning point, and the corresponding mass of oxide scale at the turning point increased with the increasing of relative humidity at 1 000 ℃. Vapor promoted the formation of a large number of defects, such as pores and microcracks inside the oxide scale, which became diffusion channels for the ions, thereby accelerating the oxidation reaction. Moreover, the vapor promoted the diffusion of Si and Mn elements, which can leads to the expansion of the element-rich layer.
Key words: high strength steelvaporhigh temperature oxidationoxidation kineticsoxide scale
高强钢是添加微合金元素并通过热轧工艺生产的工程结构钢材,在承受较大载荷的同时又能减轻结构件自重,所以被广泛应用于汽车及建筑等制造业[1-2].汽车工业的迅速发展对高强钢的需求越来越大,用户在重视产品整体性能的同时也对表面质量提出更严格的要求.一方面,钢板表面氧化铁皮引起的诸如粘附性点缺陷、氧化铁皮压入以及粉状氧化铁皮等缺陷严重影响钢材表面质量,另一方面,在冷加工过程中形成的粉状氧化铁皮造成污染环境的同时还损害工作人员的健康[3-6].
在热轧生产过程中影响氧化铁皮的因素较多且复杂,其中包括轧制温度、氧化时间、氧化气氛及合金元素含量等[7-11].在热轧过程中,带钢不仅会接触到干燥空气,而且在除鳞及水冷过程中还会与潮湿气氛进行接触反应[12].Brady等[13]和Hao等[14]研究了不同钢种在潮湿气氛中的氧化行为,发现在高温氧化过程中与干燥空气相比,水蒸气气氛显著改变了金属的氧化过程.Li等[15]研究了1 050 ℃等温条件下潮湿气氛对Fe-Cr合金高温氧化行为的影响,发现Cr元素能与水蒸气相互反应生成易挥发性物质CrO2(OH)2,导致氧化膜内出现空隙,加速钢的氧化.Jonsson等[16]研究了在500 ℃下干燥空气及水蒸气气氛对纯铁氧化进程的影响,结果表明水蒸气显著影响了氧化膜的生长机制,水蒸气加速氧化进程与晶粒度及基体表面状态有关.He等[17]研究了1 150~1 300 ℃时含Si钢在O2-N2混合氧化气氛中的氧化行为,发现高温下氧化动力学曲线遵循抛物线规律.
目前,随着下游用户的转型升级,700 MPa级高强钢已成为国内外大型钢铁企业的主力产品,考虑到钢材氧化行为贯穿热轧生产始终,且合金种类较多,由于氧化铁皮结构、厚度控制不当带来的系列表面问题严重阻碍了此类产品的进一步推广应用,特别是热轧全流程中大量水的使用,会造成整体生产环境湿度较高,热轧产品氧化行为更为复杂.为此,本文针对抗拉强度700 MPa以上的高强钢展开高温高湿度条件下的氧化行为研究,为实际加热及热轧中氧化铁皮的控制提供理论依据.
1 实验材料和方法实验用高强钢来自国内某钢厂,化学成分见表 1.将实验钢加工为2 mm×6 mm×15 mm的试样,沿试样中线方向靠短边处钻出?1.5 mm的圆孔,然后使用无水乙醇进行超声波清洗,去除表面油污及乳化液,使用600#~1 500#砂纸打磨至试样表面光洁度一致,最后清洗并烘干备用.
表 1(Table 1)
| 表 1 实验钢的化学成分(质量分数) Table 1 Chemical composition of experimental steel(mass fraction) ? | ||||||||||||||||||||||||||||||||||||||||||||||
本实验在高温同步热分析仪上进行,具体实验方法为:首先将试样悬挂于加热炉内,炉内抽真空后,再以200 mL/min速率向炉内充入氩气直至达到1.01×105 Pa,然后在氩气保护下以90 ℃/min速率升温至设定温度(1 000 ℃) 后,水蒸气发生器以20 mL/min流速向炉内通入相对湿度为0%,30%(体积分数约为1.5%) 及90%(体积分数约为4.5%) 的潮湿气氛并保温240 min.最后在氩气保护下以60 ℃/min的速率降至室温.氧化实验结束后使用场发射电子探针对氧化层厚度、断面形貌及元素分布进行观察和分析,同时采用X射线衍射仪对氧化层进行相结构分析.
2 实验结果与讨论2.1 氧化动力学分析图 1a给出了实验钢在不同相对湿度下氧化240 min后单位面积的质量变化曲线.可看出,氧化导致的质量增加量随着相对湿度的升高而呈逐渐上升趋势,但不同相对湿度下氧化增重速率各不相同,当相对湿度达到90%时,质量增加速率达到最大.在氧化增重曲线中可发现曲线存在明显的拐点,将图 1a中0~20 min内曲线放大,如图 1b所示.在不同相对湿度下的氧化初期,质量与时间呈线性关系;当氧化层生长到一定厚度时,曲线出现拐点,随着氧化时间的延长,质量与时间呈抛物线规律.
图 1(Fig. 1)
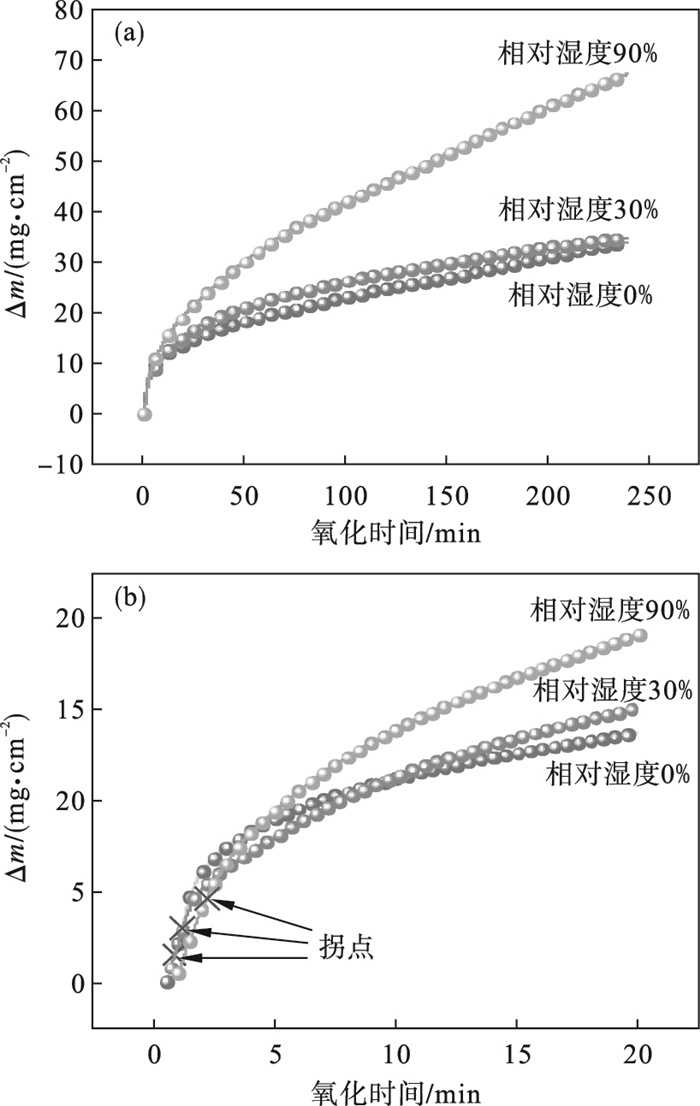 | 图 1 不同相对湿度下的氧化质量变化曲线Fig.1 Oxidation mass gain curves under various relative humidity conditions (a)—氧化240 min;(b)—氧化20 min. |
在氧化初期,试样与空气直接接触反应生成氧化层,初始的氧化物通过离散晶核的横向扩展而生长.此时界面化学反应控制着氧化速率,氧化质量变化曲线遵循直线规律.随着氧化的进行,当氧化物晶核延伸到彼此接触时,氧化层覆盖基体表面,此时离子沿垂直方向进行扩散.在高温和长时两者共同作用下,生成的氧化层变厚.铁离子通过氧化层的扩散通量与氧化层厚度成反比,随着氧化层厚度的增加,通过氧化层扩散到气相/氧化层界面上的铁离子减少,导致铁离子不能与界面上吸附的全部氧离子反应,进而减小氧化速率,使质量变化由线性规律转变为抛物线规律,此时氧化速率由离子在氧化层中的扩散速率所控制.线性及抛物线阶段的质量变化方程分别如式(1) 和式(2) 所示.
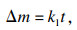 | (1) |
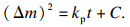 | (2) |
表 2(Table 2)
| 表 2 不同相对湿度下氧化速率常数 Table 2 Oxidation rate constant under different relative humidity conditions | |||||||||||||||
当氧化层达到一定厚度时,气相扩散控制的线性规律会向离子扩散控制的抛物线规律转变,扩散机制的改变使氧化铁皮层生长存在一个临界的厚度.根据Chen等[18-20]的推导,若用氧化铁皮的质量变化表示扩散机制的转变,可由式(3) 计算出线性-抛物线规律转变时对应氧化层的质量:
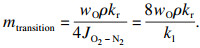 | (3) |
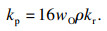 | (4) |
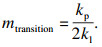 | (5) |
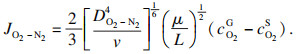 | (6) |
当将氧化性气氛中通入水蒸气,氧的扩散通量转变为三元O2-N2-H2O体系下的扩散,由于组分之间的相互作用,多组分物系扩散需要用行列式的形式表示,对于n组分物系,菲克扩散系数由DO2-N2转变为DO2-N2-H2O,表达式为
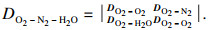 | (7) |
 | (8) |
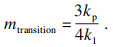 | (9) |
表 3(Table 3)
| 表 3 不同相对湿度下氧化质量增加量 Table 3 Oxidation mass gain under different relative humidity conditions mg·cm-2 |
2.2 氧化铁皮表面结构分析图 2给出了实验钢在1 000 ℃下经不同潮湿气氛氧化后的表面微观形貌.在干燥气氛下,试样表面出现了不规则多边形状的氧化物晶粒,呈明亮的灰色,且晶粒之间存在间隙;当相对湿度为30%时,氧化物晶粒减少,不规则多边形略微增大;当相对湿度为90%时,晶粒尺寸达到最大,氧化层表面更加致密,表面形成微裂纹.典型结构的氧化膜表面为Fe2O3,优先在孔状Fe3O4的边界处形核,通过Fe在氧化层中的线缺陷进行扩散生成岛状,经岛内局部垂直生长和纵向扩大而生长,最终覆盖整个Fe3O4表面[23].在潮湿空气中,水蒸气促进岛状Fe2O3内部的垂直生长和纵向扩大,导致多边形状Fe2O3晶粒尺寸扩大,最终各晶粒相互连接,覆盖整个Fe3O4层表面.
图 2(Fig. 2)
 | 图 2 1 000 ℃不同相对湿度条件下氧化层表面微观形貌Fig.2 Surface morphologies of oxide layer under different relative humidity conditions at 1 000 ℃ (a)—0%;(b)—30%;(c)—90%. |
2.3 氧化铁皮断面结构分析图 3给出了试样在不同相对湿度下保温240 min后氧化层的XRD衍射图谱,可看出氧化层中只有FeO,Fe3O4,Fe2O3,Fe2SiO4的特征谱线.结合图 4中氧化层的断面形貌,可知氧化层由靠近基体侧的FeO层、中间的Fe3O4层、最外侧的Fe2O3层及界面处Si的富集层所组成.在干燥空气下,氧化层厚度为330~345 μm,生成的氧化层较为致密,在基体与氧化铁皮结合处出现一层连续的元素富集层;当相对湿度增加到30%时,氧化层厚度为500~520 μm,氧化层中出现少量的微小孔洞;当相对湿度增加到90%时,氧化层厚度为630~650 μm,在内部出现的孔洞、裂纹更加明显.随着相对湿度的增加,氧化层的厚度逐渐增大,孔洞增多,合金元素富集层扩大.在潮湿气氛下,氧化层中形成大量的FeO并成为外氧化层中的主要相.
图 3(Fig. 3)
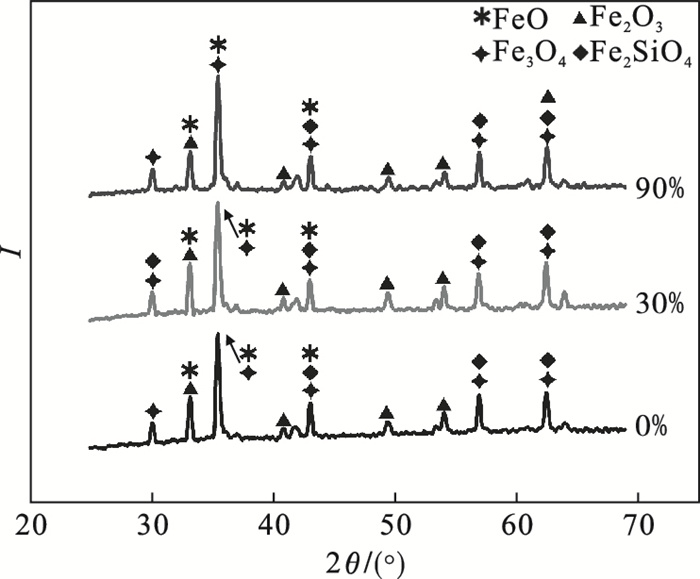 | 图 3 不同相对湿度下氧化层的XRD衍射图谱Fig.3 XRD patterns of oxide scale under different relative humidity conditions |
图 4(Fig. 4)
 | 图 4 1 000 ℃不同相对湿度条件下氧化铁皮断面形貌Fig.4 Cross-sectional morphologies of iron oxide scale under various relative humidity conditions at 1 000 ℃ (a)—0%;(b)—30%;(c)—90%. |
图 5为试样在1 000 ℃干燥空气和相对湿度为90%的水蒸气气氛下氧化铁皮和基体结合处的界面元素分析.Mn,Si元素的存在使外侧氧化层与基体间形成了一层连续的元素富集层,其富集区域随着相对湿度的增大而增加.当相对湿度为90%时,Mn,Si元素的富集区达到最大.
图 5(Fig. 5)
 | 图 5 1 000 ℃不同相对湿度条件下氧化铁皮和钢基体的界面元素分析Fig.5 Interfacial elements analysis of iron oxide and steel matrix under different relative humidity conditions at 1 000 ℃ (a)—0%;(b)—90%. |
添加适量的Mn元素常用于扩大γ-Fe相区,从而改善钢材的力学性能,使之具有高强度和良好的成形性能.而氧化铁皮的FeO内部的Mn和Fe原子比与合金基体中的Mn和Fe原子比相似.在发生高温氧化以及结构转变时,标准大气压下可以形成固溶体FeO-MnO.如图 6所示,根据文献[24],通过基于热力学理论的Calphad方法计算的FeO-MnO相图可以证明,在700 ℃下的Fe和Mn在空气中可以同时被氧化,在氧化铁皮层会由FeO-MnO固溶体组成.而在1 000 ℃氧化时,Si元素与FeO易形成固溶产物Fe2SiO4,由于氧化温度低于Fe2SiO4的熔点,Fe2SiO4以固态的形式富集在基体与氧化铁皮的界面处,阻碍铁离子扩散的同时对Mn离子扩散起到一定的阻碍作用,使Mn元素富集在基体与氧化铁皮界面处.水蒸气中氢质子溶解在氧化物中并富集在晶界处,增加质子缺陷的浓度并影响着晶界的扩散[25].所以当相对湿度为90%时,元素富集层最大.
图 6(Fig. 6)
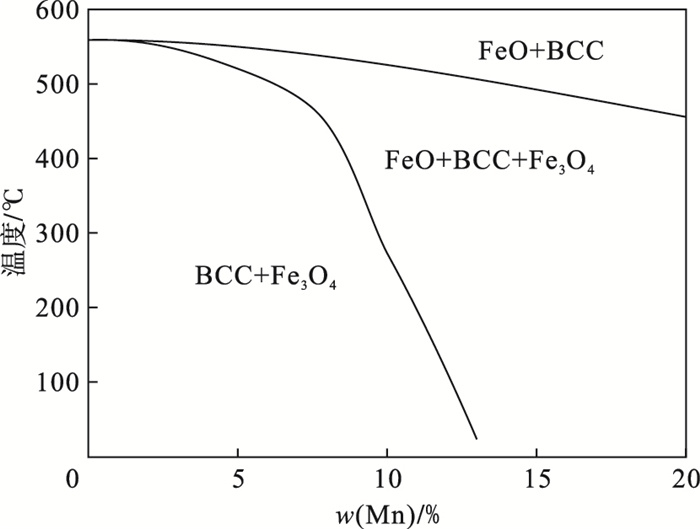 | 图 6 FeO-MnO相图Fig.6 FeO-MnO phase diagram |
2.4 水蒸气对氧化行为的影响机理图 7a为氧化层在干燥空气条件下的形成机理,FeO和Fe3O4内部的缺陷主要以阳离子空位为主,Fe2+和Fe3+易通过铁离子空位向外侧扩散.由基体侧扩散而来的Fe2+经FeO层中的阳离子空位到达FeO/Fe3O4界面,Fe2+与Fe3O4发生还原反应生成FeO,维持了FeO层的生长.当Fe2+扩散到Fe3O4/Fe2O3时,Fe2O3被还原成Fe3O4,维持了Fe3O4层的生长.Fe2O3内部的缺陷主要以阴离子空位为主,外界的氧分子在Fe2O3/O2相界面处发生解离,生成的O2-易通过Fe2O3层内的阴离子空位向内扩散.与此同时,Fe3O4中的Fe3+扩散到Fe3O4/Fe2O3界面处与O2-发生氧化还原反应生成Fe2O3.
图 7(Fig. 7)
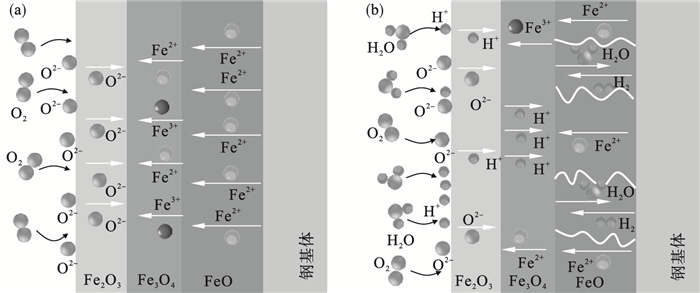 | 图 7 水蒸气条件下氧化铁皮的生长机制Fig.7 Growth mechanism of oxide scale under water vapor condition (a)—干燥空气;(b)—潮湿空气. |
水蒸气与Fe氧化物反应易生成挥发性物质,当挥发性物质向外传质速度过慢或受阻时,导致氧化层内气体压力增加,压力达到一定程度时会使氧化层内生成孔洞.此外,由氧化动力学分析得出,在水蒸气条件下的氧化速率明显高于干燥空气,氧化层快速生长,内部生长应力增加,当生长应力高于氧化层塑性变形极限时,氧化层会产生变形或开裂现象,促使内部微裂纹的形成.在潮湿气氛下,氧化层的生长机理如图 7b所示.潮湿气氛中的水蒸气会吸附在氧化层的外表面并发生解离,向内部提供更多氧的同时也促使氧沿晶界扩散[25-26].H2O也在氧化层表面解离为H+,H+的半径小会沿着晶界或晶格间隙向内扩散到氧化层内部,当H+扩散到FeO层时会反应生成H2O.H2O通过微裂纹扩散到基体表面并与基体反应生成H2和FeO,此时H2会沿着微裂纹反向扩散到FeO层.如此反复使裂纹和孔洞成为气相物质扩散通道的同时,也为铁离子向外迁移提供了较短的路径,在两种机制综合作用下,加速了实验钢氧化,也显著改变氧化铁皮的形态,使FeO相成为外氧化层的主要成分.
3 结论1) 实验钢在相同的氧化温度下,相对湿度越高,生成的氧化层越厚,并且在不同相对湿度下的氧化质量变化曲线均遵循先直线后抛物线规律.
2) 当氧化质量变化曲线由线性规律转变为抛物线规律时,曲线有拐点存在.拐点处氧化层的质量随相对湿度的升高而增加.加热炉内的气体流动模式不满足推导k1的条件,使拐点处氧化层质量的理论计算值与实验室结果存在差异.
3) 在潮湿气氛中,水蒸气促进氧化层表面晶粒的生长;水蒸气条件下生成的外氧化层中存在大量的孔洞及微裂纹,这些缺陷的存在促进了气相物质及离子的扩散,加快了氧化反应,使FeO层成为外氧化层中主要相;水蒸气促进了Si和Mn元素的扩散,使元素富集区扩大.
参考文献
| [1] | 施刚, 班慧勇, 石永久, 等. 高强度钢材钢结构研究进展综述[J]. 工程力学, 2013, 30(1): 1-13. (Shi Gang, Ban Hui-yong, Shi Yong-jiu, et al. Overview of research progress for high strength steel structures[J]. Engineering Mechanics, 2013, 30(1): 1-13.) |
| [2] | 强旭红, 毋凯冬, 姜旭, 等. 高强钢S460高温力学性能研究与抗火设计建议[J]. 湖南大学学报(自然科学版), 2018, 45(11): 37-45. (Qiang Xu-hong, Wu Kai-dong, Jiang Xu, et al. Study on mechanical properties of high strength steel S460 at elevated temperatures and fire-resistance design recommendations[J]. Journal of Hunan University(Natural Sciences), 2018, 45(11): 37-45.) |
| [3] | 曹光明, 石发才, 孙彬, 等. 汽车大梁钢的氧化铁皮结构控制与剥落行为[J]. 材料热处理学报, 2014, 35(11): 161-167. (Cao Guang-ming, Shi Fa-cai, Sun Bin, et al. Oxide scales control and spallation behavior of hot-rolled automotive frame steels[J]. Transactions of Materials and Heat Treatment, 2014, 35(11): 161-167.) |
| [4] | Li Y C, Liu Z L, Liu H, et al. Clean strengthening reduction of lead and zinc from smelting waste slag by iron oxide[J]. Journal of Cleaner Production, 2017, 143(1): 311-318. |
| [5] | Kladnig W F. New development of acid regeneration in steel pickling plants[J]. Journal of Iron and Steel Research International, 2008, 15(4): 1-6. DOI:10.1016/S1006-706X(08)60134-X |
| [6] | Yu Y C, Lenard J G. Estimating the resistance to deformation of the layer of scale during hot rolling of carbon steel strips[J]. Journal of Materials Processing Technology, 2002, 121(1): 60-68. DOI:10.1016/S0924-0136(01)01176-1 |
| [7] | Cheng X W, Jiang Z Y, Monaghan B J, et al. Breakaway oxidation behaviour of ferritic stainless steels at 1 150 ℃ in humid air[J]. Corrosion Science, 2016, 108: 11-22. DOI:10.1016/j.corsci.2016.02.042 |
| [8] | Abuluwefa H, Guthrie R I L, Ajersch F. The effect of oxygen concentration on the oxidation of low-carbon steel in the temperature range 1 000~1 250 ℃[J]. Oxidation of Metals, 1996, 46(5): 423-440. DOI:10.1007%2FBF01048639 |
| [9] | Lee V H J, Gleeson B, Young D J. Scaling of carbon steel in simulated reheat furnace atmospheres[J]. Oxidation of Metals, 2007, 63(1/2): 15-31. DOI:10.1007/s11085-005-1949-0 |
| [10] | Martinelli L, Desgranges C, Rouillard F, et al. Comparative oxidation behaviour of Fe-9Cr steel in CO2 and H2O at 550 ℃: detailed analysis of the inner oxide layer[J]. Corrosion Science, 2015, 100(11): 253-266. |
| [11] | Yuan J T, Wang W, Zhu S L, et al. Comparison between the oxidation of iron in oxygen and in steam at 650~750 ℃[J]. Corrosion Science, 2013, 75(10): 309-317. |
| [12] | Cheng X W, Jiang Z Y, Wei D B, et al. Oxide scale characterization of ferritic stainless steel and its deformation and friction in hot rolling[J]. Tribology International, 2015, 84: 61-70. DOI:10.1016/j.triboint.2014.11.026 |
| [13] | Brady M P, Keiser J R, More K L, et al. Comparison of short-term oxidation behavior of model and commercial chromia-forming ferritic stainless steels in dry and wet air[J]. Oxidation of Metals, 2012, 78(1/2): 1-16. DOI:10.1007%2Fs11085-012-9289-3 |
| [14] | Hao L, Jiang Z Y, Chen Z X, et al. High temperature oxidation of indefinite chill roll material under dry and humid atmospheres[J]. Steel Research International, 2016, 87(3): 349-358. DOI:10.1002/srin.201500063 |
| [15] | Li Z F, Cao G M, He Y Q, et al. Effect of chromium and water vapor of low carbon steel on oxidation behavior at 1 050 ℃[J]. Steel Research International, 2016, 87(11): 1469-1477. DOI:10.1002/srin.201500429 |
| [16] | Jonsson T, Pujilaksono B, Hallstrom S, et al. An ESEM in situ investigation of the influence of H2O on iron oxidation at 500 ℃[J]. Corrosion Science, 2009, 51(9): 1914-1924. DOI:10.1016/j.corsci.2009.05.016 |
| [17] | He B, Xu G, Zhou M X, et al. Effect of oxidation temperature on the oxidation process of silicon-containing steel[J]. Metals, 2016, 6(6): 1-9. |
| [18] | Chen R Y, Yuen W Y D. Short-time oxidation behavior of low-carbon, low-silicon steel in air at 850~1 180 ℃.Ⅱ: linear to parabolic transition determined using existing gas-phase transport and solid-phase diffusion theories[J]. Oxidation of Metals, 2010, 73(3/4): 353-373. DOI:10.1007/s11085-010-9212-8 |
| [19] | Chen R Y, Yuen W Y D. Short-time oxidation behavior of low-carbon, low-silicon steel in air at 850~1 180 ℃.Ⅰ: oxidation kinetics[J]. Oxidation of Metals, 2008, 70(5/6): 39-68. DOI:10.1007/s11085-008-9111-4 |
| [20] | Yuen W Y D, Chen R Y. Short-time oxidation behavior of low-carbon, low-silicon steel in air at 850~1 180 ℃.Ⅲ: mixed linear-and-parabolic to parabolic transition determined using local mass-transport theories[J]. Oxidation of Metals, 2010, 74(5/6): 255-274. DOI:10.1007/s11085-010-9212-8 |
| [21] | Levich V G. Physicochemical hydrodynamics[M]. Prentice-Hall: Englewood Cliffs, 1962: 87. |
| [22] | Selenz H J, Oeters F. A contribution to the scaling of steel in technical flue gases[J]. Archiv für das Eisenhüttenwesen, 1984, 55(5): 201-208. DOI:10.1002/srin.198405437 |
| [23] | Goursat A G, Smeltzer W W. Kinetics and morphological development of the oxide scale on iron at high temperatures in oxygen at low pressure[J]. Oxidation of Metals, 1973, 6(2): 101-116. DOI:10.1007/BF00614658 |
| [24] | 曹光明, 刘怡私, 高欣宇, 等. 700 MPa级别热轧高强钢氧化铁皮结构转变规律[J]. 工程科学学报, 2019, 41(12): 1591-1598. (Cao Guang-ming, Liu Yi-si, Gao Xin-yu, et al. Structural transformation of oxide scale of 700 MPa grade hot rolled high strength steel[J]. Chinese Journal of Engineering, 2019, 41(12): 1591-1598.) |
| [25] | Yun J Y, Ha S A, Kang C Y, et al. Oxidation behavior of low carbon steel at elevated temperature in oxygen and water vapor[J]. Steel Research International, 2013, 84(12): 1252-1257. DOI:10.1002/srin.201300039 |
| [26] | Guillou S, Cabet C, Desgranges C, et al. Influence of hydrogen and water vapour on the kinetics of chromium oxide growth at high temperature[J]. Oxidation of Metals, 2011, 76(3/4): 193-214. DOI:10.1007/s11085-011-9246-6 |
