
 , 冯敬武, 姜林宏
, 冯敬武, 姜林宏 东北大学 冶金学院, 辽宁 沈阳 110819
收稿日期:2020-07-16
基金项目:国家自然科学基金资助项目(51706037);东北大学大学生创新训练计划项目(191126)。
作者简介:胡贤忠(1984-),男,山东枣庄人,东北大学讲师,博士。
摘要:可燃极限是表征燃烧特性的重要参数之一.本文以5L圆柱形反应器为基础, 搭建了可燃极限实验系统, 对O2/CO2气氛下乙烷的可燃极限进行研究, 并与空气气氛下乙烷的可燃极限进行了对比.结果表明, 高浓度的CO2降低了可燃气的可燃上限, 提高了可燃气的可燃下限, 分析了高浓度CO2对可燃极限的影响机理.根据热理论, 推导出C2H6/O2/CO2可燃极限的计算方法, 将实验值与计算值进行比较, 平均绝对偏差在2.2%以内, 两者吻合较好.
关键词:O2/CO2气氛燃烧特性可燃极限乙烷热理论
Experimental Study and Calculation of Ethane Flammability Limit Under O2/CO2 Atmosphere
HU Xian-zhong

 , FENG Jing-wu, JIANG Lin-hong
, FENG Jing-wu, JIANG Lin-hong School of Metallurgy, Northeastern University, Shenyang 110819, China
Corresponding author: HU Xian-zhong, E-mail: huxz@smm.neu.edu.cn.
Abstract: The flammability limit is an important parameter of combustion characteristics. In this paper, a flammability limit experimental device was set up based on the 5L cylindrical reactor. The flammability limits of ethane under CO2/O2 atmosphere were studied and compared with those in air atmosphere. The results showed that high concentration of CO2 reduces the upper flammability limit and increases the lower flammability limit of gas mixture. The influence of high concentration of CO2 on flammability limit was analyzed. The formula of calculation of flammability limit for C2H6/O2/CO2 was deduced according to the thermal theory. The average absolute deviation between the experimental values and calculated values is within 2.2%. The values of calculation are in agreement with the experimental data.
Key words: O2/CO2 atmospherecombustion characteristicflammability limitethanethermal theory
近年来, 全球气候变暖越来越明显, 二氧化碳等温室气体的过量排放是罪魁祸首。为减少二氧化碳的排放,世界各国加强了对碳捕集技术的开发[1].O2/CO2燃烧技术是具有代表性的碳捕集技术, 具有广阔的发展前景.O2/CO2燃烧技术使用纯氧作氧化剂, 循环烟气作稀释剂, 燃烧产物主要是水和二氧化碳,能够大幅度降低碳捕集成本.气体燃料的可燃极限是燃料燃烧特性的主要内容之一, 对可燃混合气的生产、储存及工业应用有重要意义.可燃极限也称为爆炸极限或火焰传播极限等.Turns[2]对可燃极限给出如下定义: 可燃下极限是允许稳态火焰传播的燃料含量最低值, 可燃上极限是允许火焰传播的燃料含量最高值.可燃极限通常用混合气中燃料体积分数表示.可燃上极限和可燃下极限共同确定了燃料可燃的浓度范围, 即可燃区域.可燃极限是定量表征燃料能否发生火灾、爆炸的极限浓度值, 也是评价燃料火灾、爆炸危险性的重要参数之一[3].可燃混合气的可燃极限与混合气的状态(温度、压力、气体组成)、点火能、容器的扩展性(容器的几何形状、火焰传播方向)等因素有关[4], 所以可燃混合气在O2/CO2气氛与空气气氛下的可燃极限明显不同.目前, 在空气气氛下, 常见碳氢燃料可燃极限的数据十分详实, 如Kondo等[5]实验研究了在空气气氛下CO2的稀释对甲烷、甲酸甲酯、丙烯、丙烷和二氟乙烷的可燃极限的影响, 所得的可燃极限值符合扩展的Le Chatelier公式.罗振敏等[6]采用标准的可燃性气体爆炸极限测试装置, 测量N2和CO2的稀释作用下丙烯在空气气氛下的爆炸极限, 结果表明N2和CO2都对丙烯爆炸极限有良好的惰化效果.Tian等[7]使用临界温度计算了CO2稀释条件下的碳氢化合物的可燃极限,该计算方法适用于所有碳氢化合物(甲烷、丙烷、异丁烷、丙烯和乙烯).任常兴等[8]介绍了测定可燃混合气爆炸极限的主要方法: 球式测定法和管式测定法, 分别采用火焰传播距离(≥100mm)和爆炸压力增量指标(5%或7%)判定爆炸现象, 并给出几种典型可燃气体(CH4, C2H6, C3H8, C4H10)在不同测定装置下的爆炸极限值.Le Chatelier公式是基于实验提出的能预测多组分燃料可燃极限的经验公式, 该公式预测可燃下极限较为准确, 但是预测可燃上极限存在偏差.Andrés等[9]分析了Le Chatelier公式估算空气中燃料混合物可燃上极限时误差偏大的原因, 对现有的可燃极限数据统计分析, 发现火焰传播的方向对误差影响显著.燃料可燃极限的大量实验研究为实际工程应用提供了丰富的数据.上述研究大部分集中于在空气中的可燃极限或者多种可燃混合气的可燃极限, 而在O2/CO2气氛下, 单一碳氢可燃气的可燃极限研究并不多.现有的研究主要是关于甲烷在O2/CO2气氛下的可燃极限.例如, Denedetto等[10]采用5 L的圆柱形容器进行了甲烷爆炸实验, 测试CH4/O2, CH4/O2/惰性气体的可燃极限.Hu等[11]采用理论计算和实验研究相结合的方法研究了CH4/CO2/O2的可燃极限, 并推导出计算模型.O2/CO2气氛下碳氢燃料可燃极限的研究较少, 需要进行广泛研究, 为O2/CO2燃烧技术的工业应用提供基础数据.
乙烷是工业中重要的燃料和化工原料.乙烷可燃极限的研究对预防乙烷在工业应用中发生火灾、爆炸有巨大帮助.目前, O2/CO2气氛下乙烷可燃极限的研究报道几乎没有, 但其可燃极限值的研究很有必要.本文以乙烷为研究对象, 实验测得乙烷在O2/CO2气氛下的可燃极限, 然后与空气气氛下的可燃极限对比, 分析高浓度CO2对可燃极限的影响机理, 最后基于热理论建立了乙烷在O2/CO2气氛下的可燃极限的计算模型, 并将计算值与实验值对比.
1 实验装置本实验系统如图 1所示, 混合气可燃极限的测定在一个5 L圆柱形不锈钢容器内进行.反应容器侧面安装一对观察窗, 容器底部有多个接口通过管道连接3个气瓶(CO2, O2和乙烷)和压力表.在充入反应气体前, 首先将容器抽真空至-0.1 MPa.根据理想气体状态方程, 容器内气体浓度之比等于分压之比, 气体分压根据压力表确定.依次按比例通入C2H6, CO2, O2至容器内,预混气的总压力为1 bar(绝对压力), 气体温度为环境温度25 ℃.气体通入完毕后, 关闭压力表与反应容器间的阀门, 防止气体爆炸产生的巨大压力冲击损坏压力表, 静置2 min使预混气体混合均匀.反应容器中心有一对电极, 点火电压为14 kV, 电极对产生的电火花点燃预混气体, 点火时间持续0.4 s左右.点火后, 肉眼通过观察窗如果观察到容器内有蓝色火焰从电极处向上传播, 则认为气体被点燃.如果没有产生火焰或者没有形成火焰传播, 则认为气体没有被点燃.该实验方法是按照美国标准ASTM E681—09[12]进行的, 实验结果偏差很小, 在工程应用中被广泛认可.
图 1(Fig. 1)
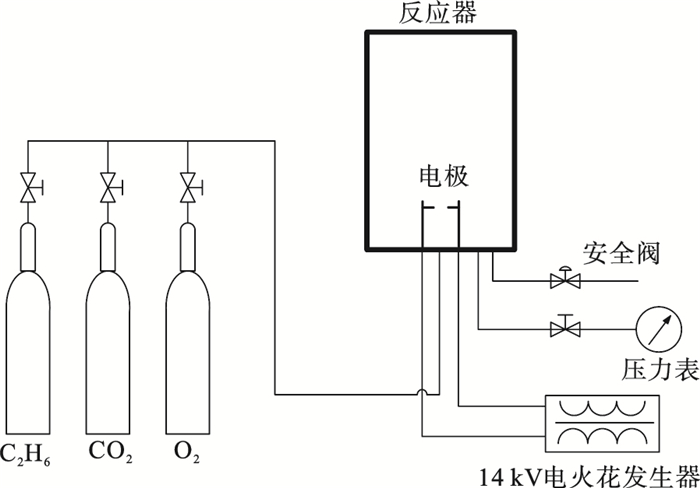 | 图 1 实验装置图Fig.1 Diagram of experimental device |
本实验中C2H6/O2/CO2混合气的可燃极限按式(1)确定,
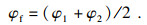 | (1) |
2 实验结果和分析通过实验, 测定出O2/CO2气氛下乙烷的可燃极限, 如图 2所示.作为对比, 甲烷在同等条件的可燃极限值也表示在图 2中.由图 2可见, 随着O2浓度的增加, 乙烷的可燃上极限逐渐增大, 可燃下极限缓慢下降, 下降速度很慢, 变化范围很窄.氧气的体积分数定义为VO2/(VCO2+VO2).由图 2可知, 氧气体积分数从20%增大到95%, 对应的可燃下极限从3.55%下降到3.25%.在O2浓度低(CO2浓度高)时, 可燃气的可燃上极限上升速度较快, 即可燃上极限变化幅度远大于可燃下极限.混合气的可燃区域可以近似看作一个三角形.
图 2(Fig. 2)
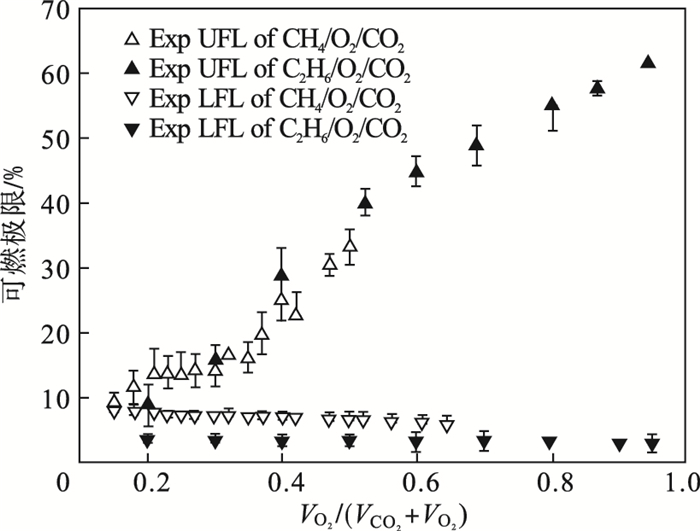 | 图 2 C2H6/O2/CO2可燃极限的实验测定值Fig.2 Experimental measurements of flammability limits of C2H6/O2/CO2 |
气体燃料在O2/CO2气氛下燃烧与在空气气氛下燃烧最大的区别是稀释气不同, 空气气氛下的稀释气是N2, O2/CO2气氛下稀释气是CO2.空气由N2与O2按79/21的比例组成.表 1为甲烷和乙烷在空气和O2/CO2气氛下部分可燃极限数据, 对比发现在O2/CO2气氛下, 高浓度CO2提高了可燃下极限, 降低了可燃上极限, 缩小了可燃范围.
表 1(Table 1)
| 表 1 CH4和C2H6在空气气氛或CO2/ O2气氛下的可燃极限 Table 1 The flammability limit of CH4 and C2H6 in the air atmosphere or in CO2/O2 atmosphere |
在空气气氛下, 乙烷的可燃下极限比甲烷小, 可燃上极限比甲烷略大, 即乙烷的可燃区域比甲烷大.在O2/CO2气氛下, O2体积分数为26.32%时甲烷的可燃极限与空气气氛下的相当, O2体积分数为24.13%时乙烷的可燃极限与空气气氛下的相当.
稀释气体(CO2和N2)对O2和可燃气的浓度起到稀释作用, 同时吸收燃烧热, 降低混合气燃烧温度和燃烧速率, 火焰无法稳定传播.由于CO2和N2的热物理和化学性质不同, 对可燃极限的影响也不相同.第一, Shang等[13]的研究表明N2和CO2的影响多体现在热效应上.CO2比N2的热容大, 对热量的吸收能力较强.与N2相比, CO2在降低火焰温度和自由基浓度方面所起的作用更大.第二, CO2作为三原子的非极性分子能进行辐射换热, 而N2是双原子的非极性分子, 不能进行气体辐射换热.O2/CO2气氛下高浓度的CO2提高了火焰黑度, 进一步加强辐射散热[14], 导致燃烧温度降低.第三, 与N2相比, CO2直接参与燃烧化学反应, 例如CO+OH


3 可燃极限计算3.1 热理论的应用常见的可燃极限计算方法, 如: Le Chatelier或其改进形式,该公式适合可燃混合气体的爆炸极限, 较为繁琐; 恒定绝热火焰温度法只适用于计算可燃下极限.常见的可燃极限计算方法大多应用在空气气氛下, 如热理论[15],给出了空气气氛下可燃极限计算公式:
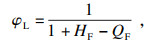 | (2) |
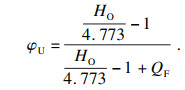 | (3) |
本文基于热理论重新推导了C2H6在O2/CO2气氛下可燃极限的计算方法.热理论[15]认为在可燃混合物系统中, 各组分都具备加热或者冷却能力, 即每种物质通过加热(释放能量)或冷却(吸收能量)来对可燃混合物系统的燃烧状态产生影响.对于燃料/氧气/稀释气混合气系统来说, 系统的放热量由燃料和氧气的量决定, 而所有的组分均在反应过程中吸收能量.忽略能量损失, 根据热理论, 在可燃上、下极限点处系统中各组分的吸热量等于放热量, 系统中各组分的吸热量和放热量的平衡确立了燃料的可燃极限.热理论中以焓为基础, 所有能量项以空气为尺度进行无量纲化, 即空气的加热和冷却能力定义为无量纲数1.0, 而燃料和稀释气的加热、冷却能力与空气的进行比较, 从而能得到燃料和稀释气对应能力的无量纲数值.
燃料和稀释气冷却能力的计算方法如下所示:
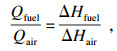 | (4) |
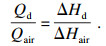 | (5) |
3.2 C2H6/O2/CO2气氛下可燃极限的计算乙烷的燃烧反应可以用以下反应方程式表示:
C2H6+3.5O2+cdCO2=2CO2+3H2O+cdCO2.
式中,cd为稀释气CO2的化学计量系数.
根据热理论, 在可燃下极限点处, 能量平衡方程(6)成立:
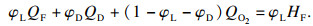 | (6) |
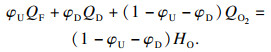 | (7) |
在可燃上极限处, 氧气完全消耗, 燃料燃烧释放的热量由氧气的量决定,如式(8)所示:
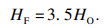 | (8) |
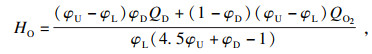 | (9) |
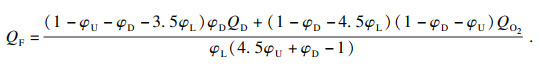 | (10) |
根据方程(6)和方程(7)可以推导出C2H6在O2/CO2气氛下可燃上、下极限的计算公式:
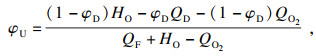 | (11) |
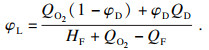 | (12) |
图 3对比了C2H6/O2/CO2混合气可燃极限的计算值和实验值.对比发现, C2H6/O2/CO2可燃下极限的计算值与实验值吻合较好, 两者的平均绝对偏差不超过1%;可燃上极限偏差略大, 两者的平均绝对偏差不超过2.2%.随着稀释气浓度的增加, 计算值呈线性变化, 且实验值总是小于计算值.这些偏差产生的原因可能是CO2的化学反应效应, 或者是热理论在推导过程的假设条件.下面对偏差的来源进行讨论.
图 3(Fig. 3)
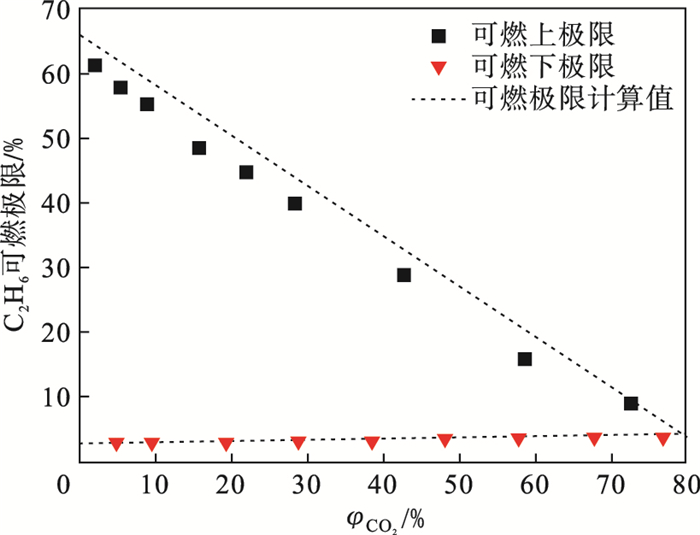 | 图 3 C2H6/O2/CO2混合气的可燃极限Fig.3 Flammability limit diagrams of C2H6/O2/CO2 mixtures |
3.3 计算误差分析3.3.1 CO2的化学反应效应带来的偏差根据链式爆炸理论, 在C2H6/O2/CO2混合气体中, 随着CO2的加入, 一方面降低了链式反应中自由基的浓度;另一方面,CO2会在反应过程中与带有活性的基团结合, 占据本该参与反应的活性基团, 减少了乙烷活化分子与氧气活化分子之间的碰撞[16], 抑制了链式爆炸反应的发展.
3.3.2 假设条件带来的偏差热理论基于两个假设条件: 一是绝热火焰温度恒定.Shebeko等[17]通过对由C, H, O, N元素组成的可燃混合气的可燃极限数据分析, 得到了在可燃下极限处不同混合气的绝热火焰温度非常接近, 在1 550 K上下波动.由于可燃上、下极限处的燃烧情况不同, 绝热火焰温度也是不同的, 在可燃下极限处, 绝热火焰温度随稀释气浓度增加变化不大, 而在可燃上极限处变化较大.热理论认为绝热火焰温度是固定值, 会对可燃上极限的计算带来误差.二是在可燃上极限处的燃烧反应是完全的, 与可燃下极限处类似.但是在可燃上极限点处, 乙烷充足, 氧气不足, 乙烷不能完全燃烧; 在可燃下极限点处, 乙烷不足, 氧气充足, 乙烷能完全燃烧.同时, 当高浓度CO2存在时, CO2对火焰的稳定传播影响更大, 使着火困难, 可燃范围更小, 所以对上极限的影响比下极限影响略大.虽然热理论两个假设条件对可燃上极限的计算带来了偏差, 但是这两个假设条件使可燃极限的计算变得简单许多,引起的偏差也在可接受范围内.
4 结论本文基于5L圆柱形反应器实验研究了乙烷在O2/CO2气氛下的可燃极限.结果表明: 随着CO2浓度增加, C2H6/O2/CO2可燃下极限从3.25%增加到3.55%, 可燃上极限从61.5%下降到9%.高浓度CO2提高了C2H6的可燃下极限, 降低了C2H6的可燃上极限, 缩小了可燃范围.主要原因是CO2降低了火焰温度和自由基浓度.
基于热理论, 推导了C2H6/O2/CO2混合气可燃极限的计算公式.实验值与计算值相比, 可燃下极限的计算值与实验值吻合较好, 可燃上极限的计算值偏差略大.经误差分析, 偏差来源于CO2的化学反应效应和热理论的两个假设条件.
参考文献
| [1] | Buhre B J P, Elliott L K, Sheng C D, et al. Oxy-fuel combustion technology for coal-fired power generation[J]. Progress in Energy and Combustion Science, 2005, 31(4): 283-307. DOI:10.1016/j.pecs.2005.07.001 |
| [2] | Turns S R. An introduction to combustion: concepts and applications[M]. 3rd ed.New York: McGraw-Hill Higher Education, 2011. |
| [3] | 尚融雪, 万嵩, 杨红霞, 等. CO2和N2惰化条件下合成气可燃下限实验研究[J]. 东北大学学报(自然科学版), 2019, 40(8): 1191-1196. (Shang Rong-xue, Wan Song, Yang Hong-xia, et al. Experimental study on the lower limit of combustion of syngas under CO2 and N2 inerting[J]. Journal of Northeastern University (Natural Science), 2019, 40(8): 1191-1196.) |
| [4] | 胡耀元, 钟依均, 应桃开, 等. H2, CO, CH4多元爆炸性混合气体支链爆炸阻尼效应[J]. 化学学报, 2004, 62(10): 956-962. (Hu Yao-yuan, Zhong Yi-jun, Ying Tao-kai, et al. Explosion damping effect of branched chain of H2, CO, CH4 multi-component explosive mixed gases[J]. Journal of Chemistry, 2004, 62(10): 956-962.) |
| [5] | Kondo S, Takizawa K, Takahashi A, et al. Extended Le Chatelier's formula for carbon dioxide dilution effect on flammability limits[J]. Journal of Hazardous Materials, 2006, 138: 1-8. DOI:10.1016/j.jhazmat.2006.05.035 |
| [6] | 罗振敏, 杨勇, 程方明, 等. N2和CO2惰化丙烯爆炸极限参数实验研究[J]. 化工学报, 2020, 71(4): 1922-1928. (Luo Zhen-min, Yang Yong, Cheng Fang-ming, et al. Experimental study on explosion limit parameters of N2 and CO2 inerted propylene[J]. Journal of Chemical Industry, 2020, 71(4): 1922-1928.) |
| [7] | Tian H, Shu G Q, Wei H Q, et al. Evaluating upper flammability limit of low hydrocarbon diluted with an inert gas using threshold temperature[J]. Chemical Engineering Science, 2015, 138: 810-813. DOI:10.1016/j.ces.2015.09.013 |
| [8] | 任常兴, 张欣, 慕洋洋, 等. 可燃气体和混合气极限氧浓度实验研究[J]. 消防科学与技术, 2017, 36(2): 156-159. (Ren Chang-xing, Zhang Xin, Mu Yang-yang, et al. Experimental study on limit oxygen concentration of combustible gas and mixture[J]. Fire Science and Technology, 2017, 36(2): 156-159.) |
| [9] | Andrés Z, Mendiburu C R, Coronado J A, et al. Difficulties on the determination of the flammability limits of fuel mixtures by the law of Le Chatelier[J]. Process Safety and Environmental Protection, 2020, 142: 45-55. DOI:10.1016/j.psep.2020.05.047 |
| [10] | Di Benedetto A, Cammarota F, Sarli V D, et al. Reconsidering the flammability diagram for CH4/O2/N2 and CH4/O2/CO2 mixtures in light of combustion-induced rapid phase transition[J]. Chemical Engineering Science, 2012, 84: 142-147. DOI:10.1016/j.ces.2012.07.045 |
| [11] | Hu X Z, Yu Q B, Sun N, et al. Experimental study of flammability limits of oxy-methane mixture and calculation based on thermal theory[J]. International Journal of Hydrogen Energy, 2014, 39(17): 9527-9533. DOI:10.1016/j.ijhydene.2014.03.202 |
| [12] | ASTM Committee on Standards.Standard test method for concentration limits of flammability of chemicals (vapors and gases): ASTM E681—09(2015)[S].West Conshohocken: ASTM International, 2015. |
| [13] | Shang R X, Zhang Y, Zhu M M, et al. Laminar flame speed of CO2 and N2 diluted H2 /CO/air flames[J]. International Journal of Hydrogen Energy, 2016, 41(33): 15056-15067. DOI:10.1016/j.ijhydene.2016.05.064 |
| [14] | 胡贤忠. CH4在O2/CO2气氛下燃烧特性的研究[D]. 沈阳: 东北大学, 2017. (Hu Xian-zhong.Study on the combustion characteristics of CH4 in O2/CO2 atmosphere[D].Shenyang: Northeastern University, 2017. ) |
| [15] | Ma T. A thermal theory for estimating the flammability limits of a mixture[J]. Fire Safety Journal, 2011, 46(8): 558-567. DOI:10.1016/j.firesaf.2011.09.002 |
| [16] | 姚福桐. 复杂工况下惰性气体对C2H6/O2爆炸极限的影响研究[D]. 大连: 大连理工大学, 2019. (Yao Fu-tong.Study on the influence of inert gas on the explosion limit of C2H6/O2 under complex working conditions[D].Dalian: Dalian University of Technology, 2019. ) |
| [17] | Shebeko Y N, Fan W, Bolodian I A, et al. An analytical evaluation of flammability limits of gaseous mixtures of combustible-oxidizer-diluent[J]. Fire Safety Journal, 2002, 37(6): 549-568. DOI:10.1016/S0379-7112(02)00007-3 |
