在众多治疗模式中,光热治疗法是利用近红外光直接照射肿瘤部位,并通过光敏剂将光能转化成热能,从而有效地杀死肿瘤细胞而不引起系统毒性。因此该疗法被公认为一种无侵害的治疗模式。研究表明,光热治疗和化疗具有很好的协同效果。因此,化疗结合光热治疗具有很好的临床转化潜能。然而,如何实现同时将精准剂量的化疗药物和光敏剂输送到肿瘤部位,以达到最大的治疗效果,成为了这种综合治疗的难题。
最近,苏州医工所检验室董文飞研究员课题组的王政等人开发出一种纳米粒子——Janus型金介孔二氧化硅纳米粒子。利用该粒子担载化疗药物阿霉素,成功实现了对肝癌的化疗和光热治疗的协同治疗。
Janus型金介孔二氧化硅纳米粒子是由金纳米棒和介孔二氧化硅两部分组成。金纳米棒作为光敏剂可以通过表面等离子共振效应诱导近红外光转化成热能杀死肿瘤细胞,而介孔二氧化硅由于其表面可修饰性和极好的介孔性质,可以用于担载运输化疗药物。这种复合型纳米粒子可以将光敏剂和化疗药物同时输送到肿瘤部位,发挥了两种模式协同治疗的效果。且该纳米粒子相比于传统的核壳结构,具有明显的结构优势。即金纳米棒裸露在外,与介孔二氧化硅互不干扰,因此相比于被二氧化硅包裹着的金纳米棒具有更强的光热转化能力。
本课题组通过实验,探讨了这种Janus型金介孔二氧化硅纳米载药平台在肝癌协同治疗上的潜能。实验结果表明,研究制备的Janus型金介孔二氧化硅纳米粒子具有均一的形貌,极好的表面等离子共振波长和极高的表面积。载药后的纳米粒子不仅展现了高的药物担载能力,且呈现了pH响应性释药的特点。即在酸性条件下缓慢释放药物,在中性条件下几乎不释放药物。这意味着该纳米载药系统对微环境呈酸性的肿瘤细胞具有更强的杀伤力,而对正常细胞则几乎没有副作用。在细胞实验中,协同治疗组对人肝癌HepG2细胞的抑制率明显高于化疗组和光热治疗组,而对正常人肝细胞HL-7702展现了较低的杀伤性。因此,可以得出结论:Janus金介孔二氧化硅纳米载药平台具有高效低毒的抗肿瘤特征。相关工作已发表在RSC advance,2016, 6, 44498–44505 (SCI, IF=3.289),文章链接:
http://pubs.rsc.org/-/content/articlelanding/2016/ra/c6ra04183c#!divAbstract
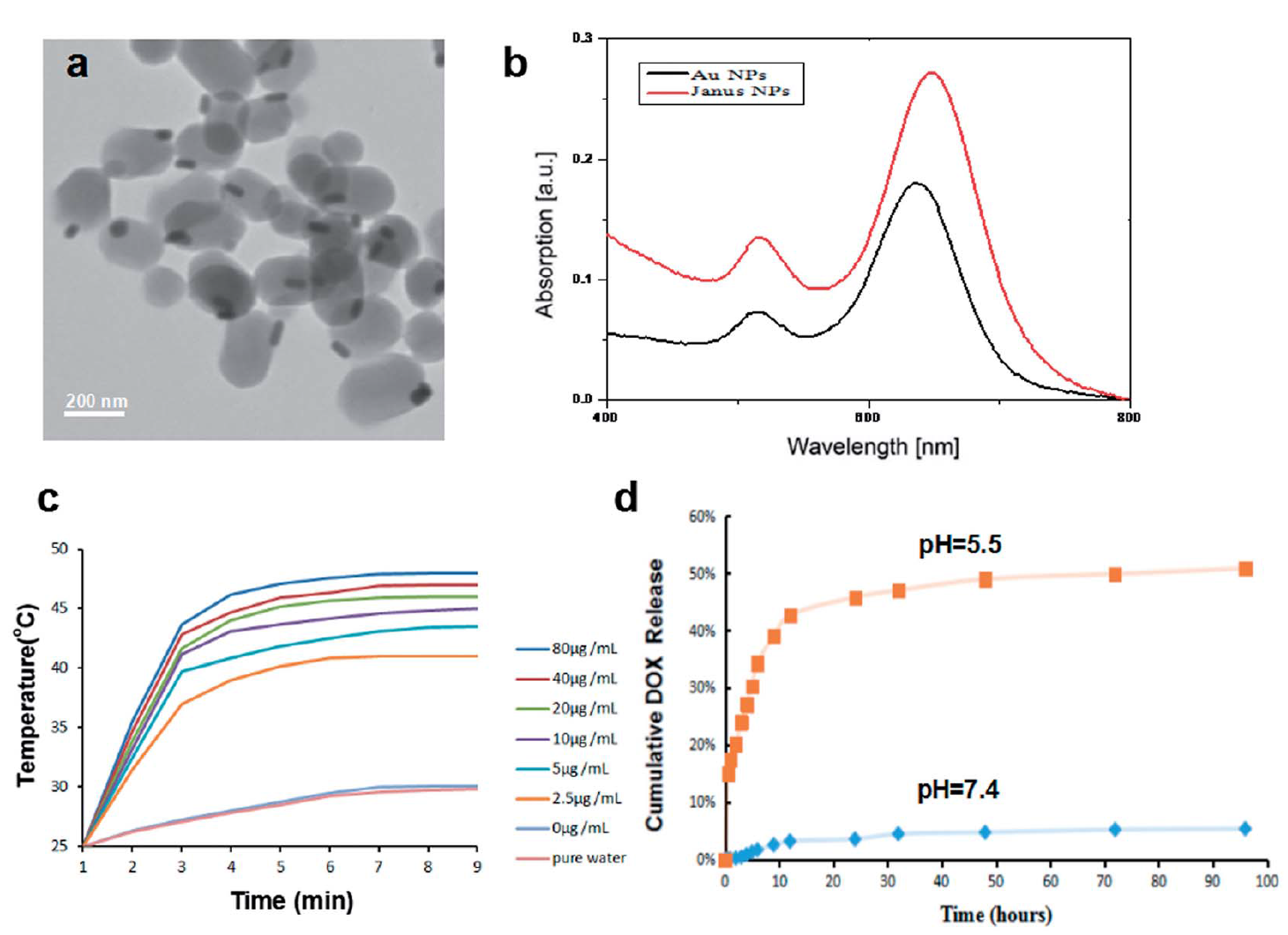
图1为Janus型金介孔二氧化硅纳米粒子的形貌性质的表征a)透射电镜b)紫外吸收峰c)近红外光诱导纳米粒子的升温情况d)不同pH下阿霉素释放情况。如图所示,该纳米粒子展现了均一的形貌,强的近红外吸收,高效的光热转换能力和pH响应性释药的特点。
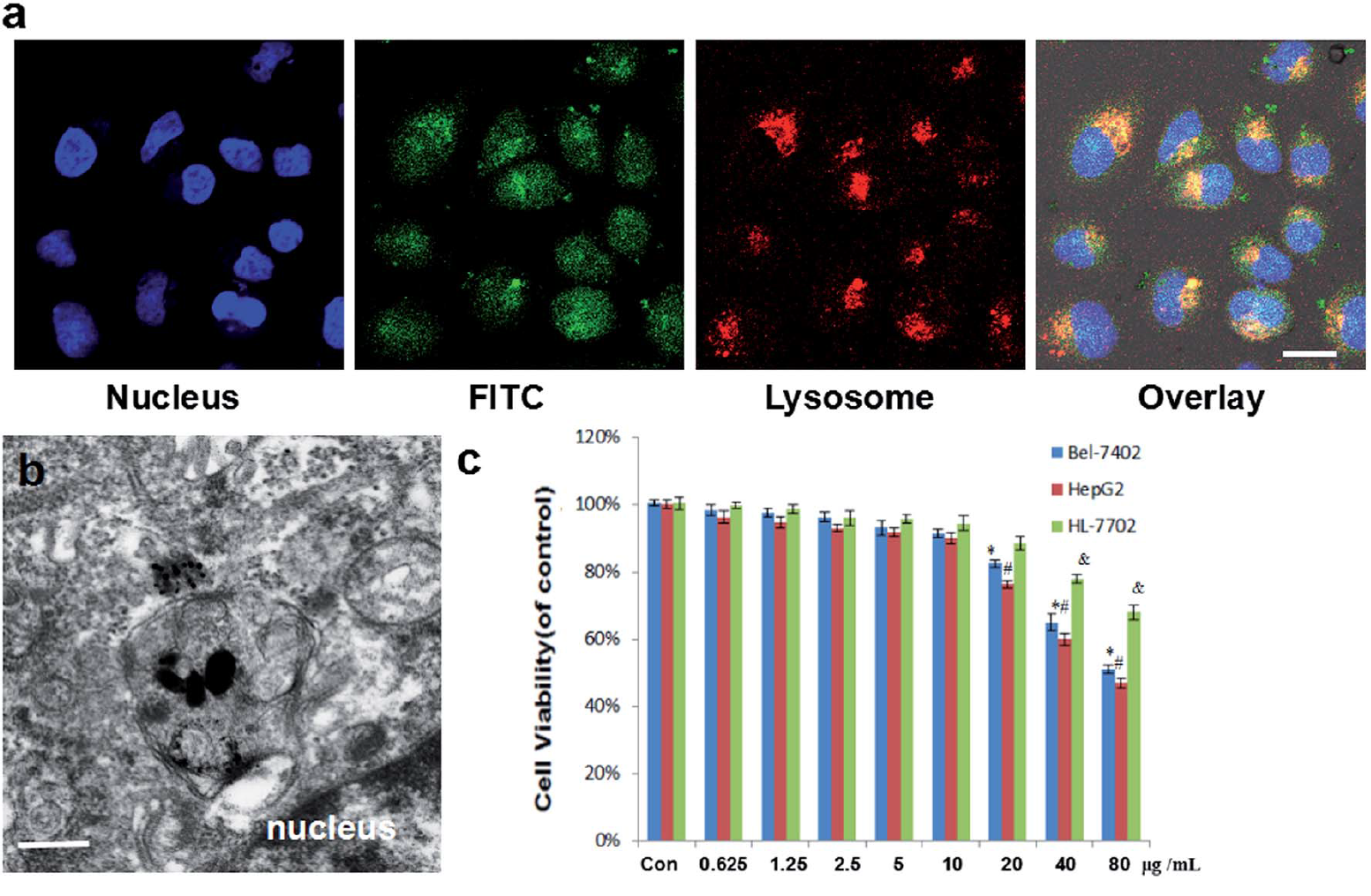
图2为Janus型纳米粒子的生物相容性测定a) 细胞内吞机制的研究b)生物电镜c)空载的粒子的细胞毒性。由此可见,该纳米粒子可以通过溶酶体进入细胞,且空载的纳米粒子具有毒性低的特点。
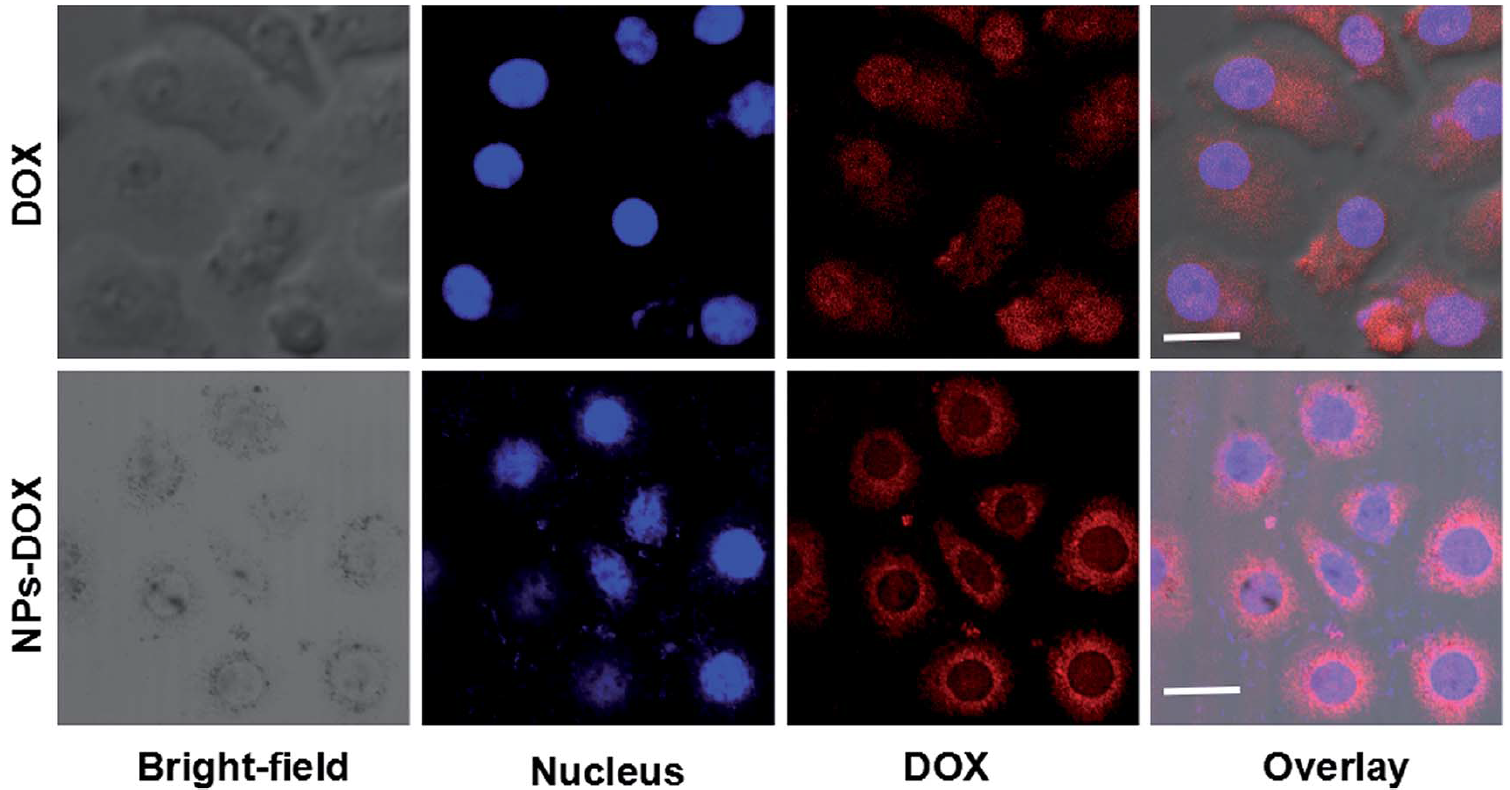
图3为Janus型金介孔二氧化硅载药系统在HepG2细胞内药物的释放。相比于单纯阿霉素,Janus型金介孔二氧化硅载药系统释放的阿霉素更多。
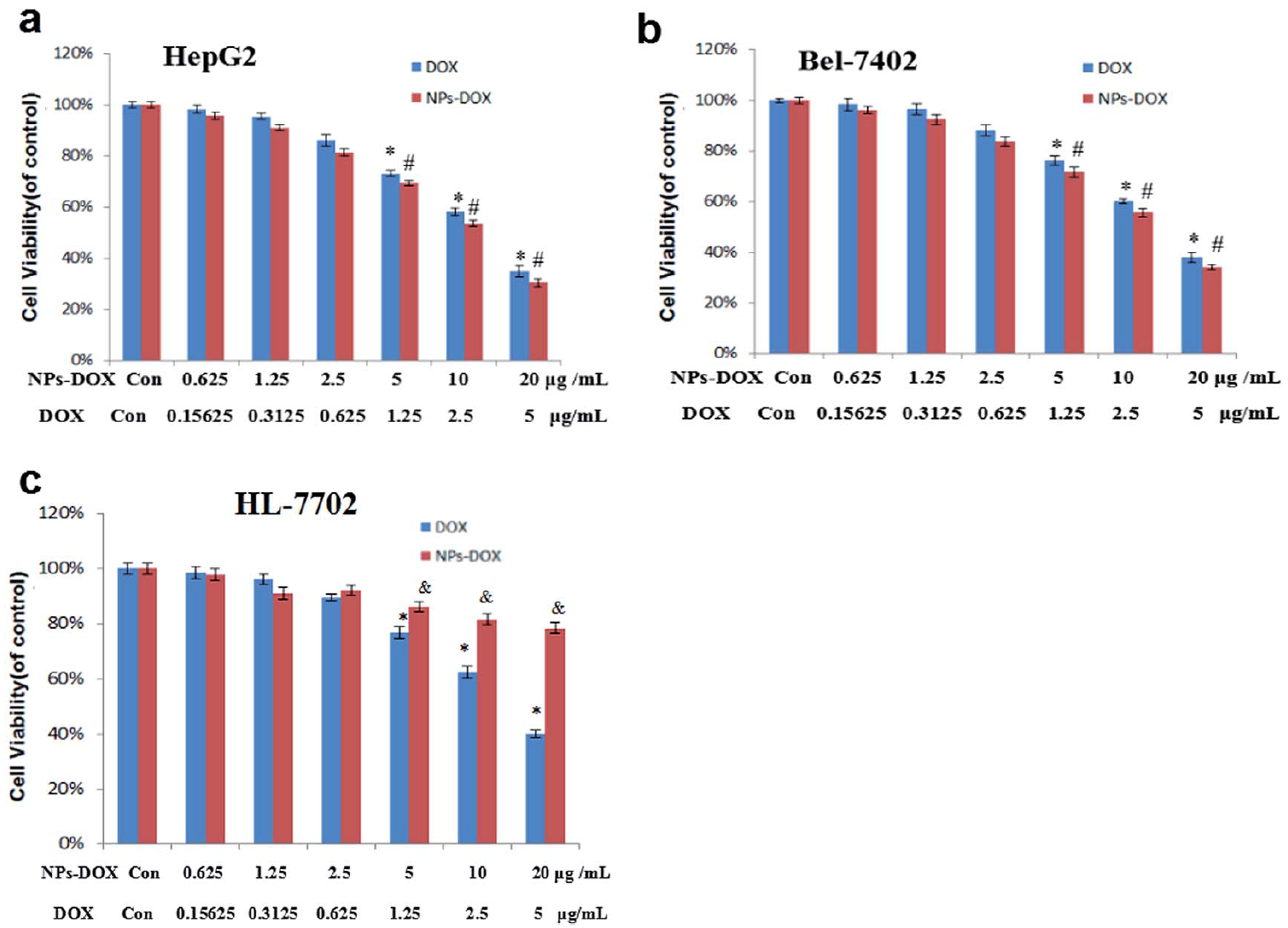
图4为Janus金介孔二氧化硅纳米粒子担载阿霉素的细胞生长抑制情况。由此可见,相比于单纯阿霉素组,Janus型金介孔二氧化硅纳米载药系统对肿瘤细胞杀伤效果更强。而在正常细胞中,该纳米载药系毒性低于阿霉素组。
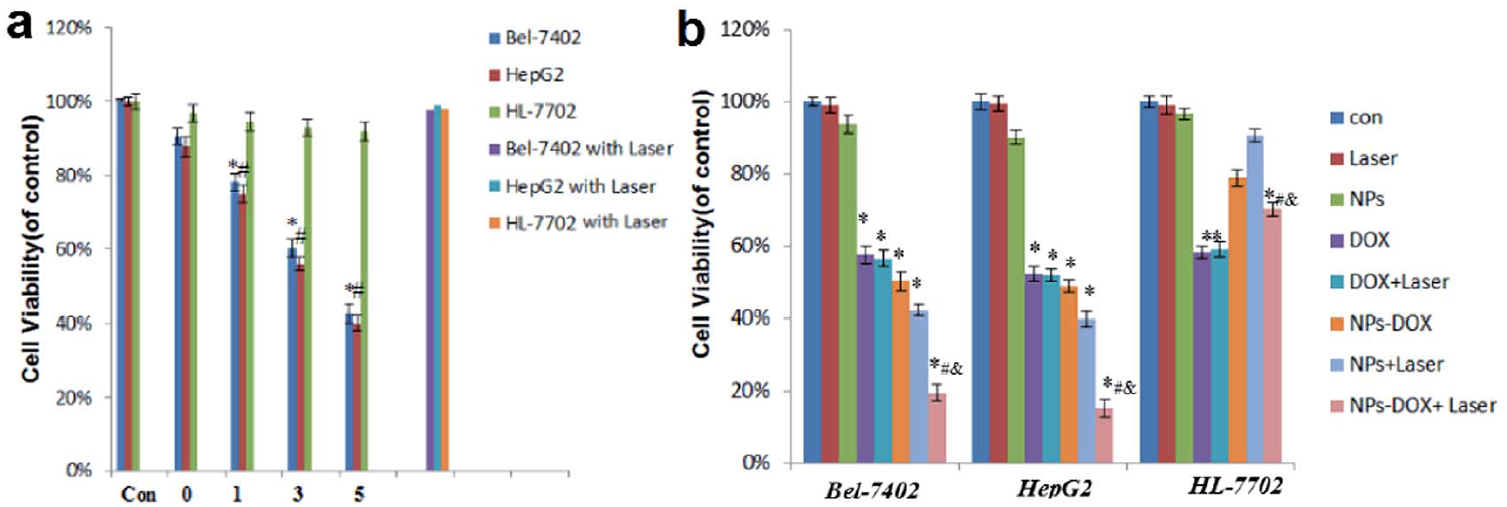
图5为Janus型金介孔纳米载药系统协同治疗的效果。光热治疗效果呈时间依赖性。相比于化疗组和光热治疗组,协同治疗组展现了更强的抗肿瘤效果和更低的毒副作用。
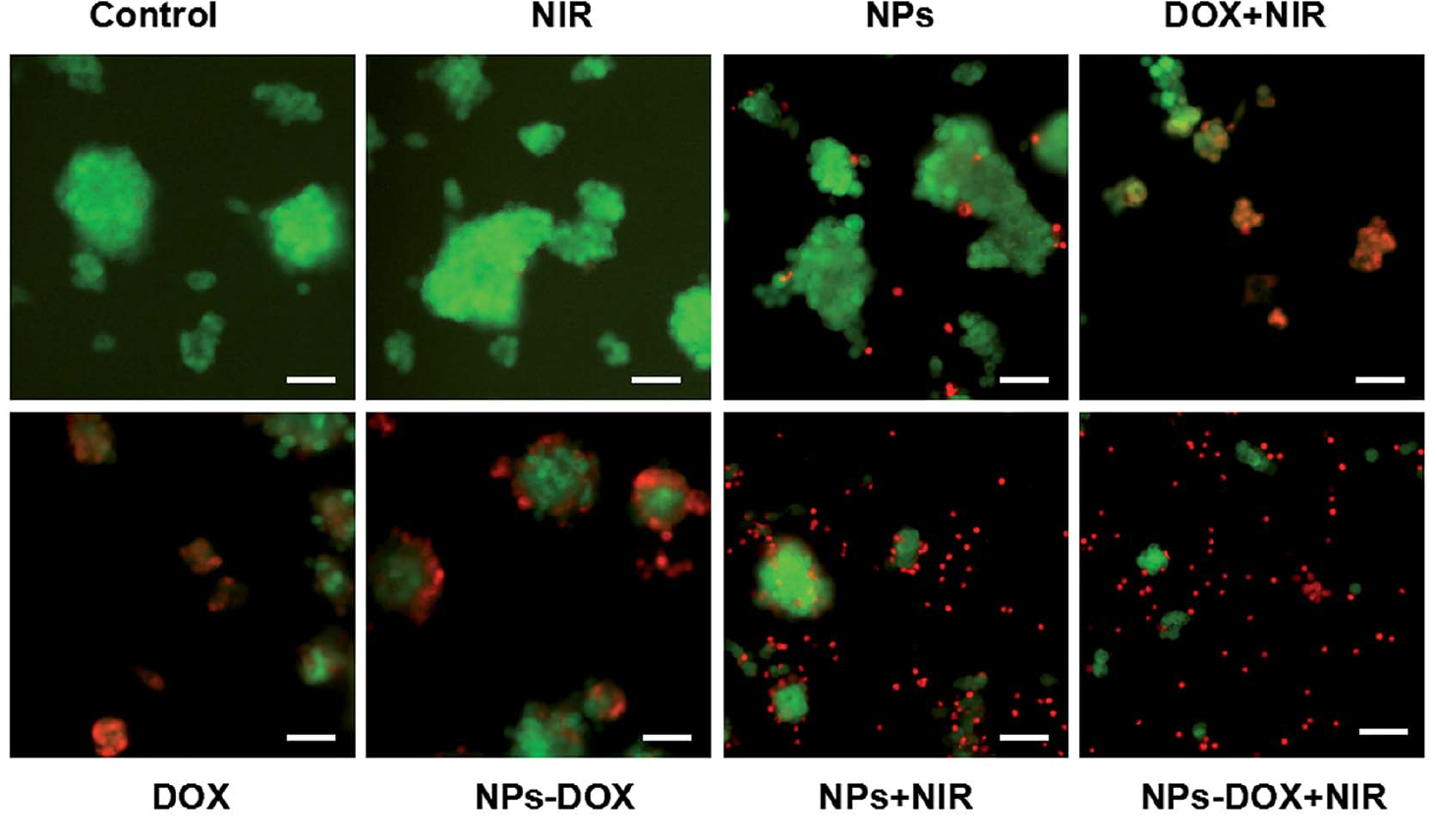
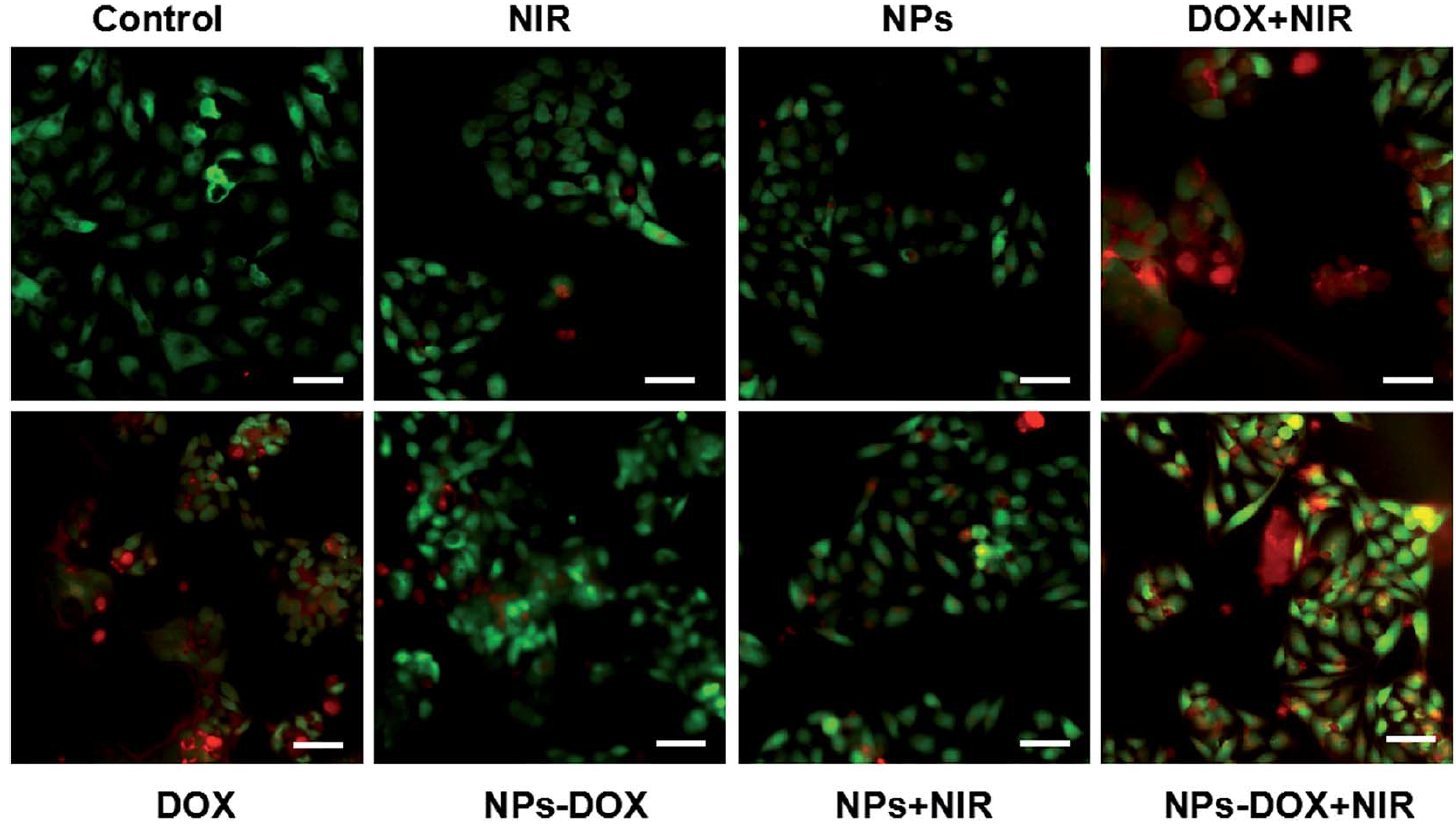
图6为活死细胞染色对比不同组的细胞杀伤情况。在协同治疗组中,死亡的肿瘤细胞最多。而对于正常细胞的损伤,协同治疗组明细低于阿霉素组。由此可以得出,该纳米载药系统具治疗效果强,毒副作用小的特点。
