基因组不稳定性和蛋白稳态失衡是癌细胞的重要特点,在细胞内分别受DDR和ER Stress反应信号通路调控,对细胞命运具有重要调控作用。在包括癌症在内的许多人类疾病中,这两种信号通路经常处于共激活状态。尽管已有研究表明内质网应激反应中的未折叠蛋白反应(Unfolded Protein Response, UPR)和DDR之间存在密切关系和复杂的串扰,但内质网应激反应的另一重要途径——内质网相关蛋白质降解(ER-associated Protein Degradation, ERAD)与DDR之间的分子机制和调控关系尚不清楚。
胡颖课题组通过生物信息学分析发现,内质网应激与DNA损伤修复通路相关。经过进一步的实验结果表明,内质网应激诱导多种肿瘤细胞发生DNA损伤,并伴有DNA-PK-NHEJ DDR信号通路特异性激活,但在持续应激下,DNA-PK-NHEJ 则被抑制,经后续研究发现DNA-PK-NHEJ信号的动态变化主要由KU70/KU80蛋白水平的改变所致。
课题组通过进一步探讨持续内质网应激条件下KU70/KU80蛋白水平下降的分子机制发现,ERAD E3连接酶HRD1和TRIM25在其中发挥了关键作用。HRD1作为定位于内质网的ERAD连接酶,通过介导组蛋白去乙酰化酶HDAC1的泛素化修饰和蛋白酶体降解,阻断了HDAC1介导的KU70/KU80去乙酰化反应,提高了二者的乙酰化水平,从而增强了TRIM25对KU70/KU80的结合能力,进而促进TRIM25催化KU70/KU80泛素化修饰和蛋白降解。敲低HDAC1或应用HDAC/DNAPK抑制剂联合内质网应激诱导剂Celecoxib可显著抑制肿瘤生长(如图)。该研究为深入理解ER Stress如何将应激信号传递至细胞核内,进而影响DDR提供重要线索,并通过体外和体内肿瘤模型验证了这一机制的潜在靶向治疗意义。
哈工大生命科学和医学学部胡颖教授为论文通讯作者,博士研究生向知渊为论文第一作者。华大基因侯桂雪博士、哈工大生命科学和医学学部郑善亮助理教授参与相关研究工作。该研究得到哈尔滨医科大学附属肿瘤医院李栗副主任医师和复旦大学基础医学院雷群英教授大力支持。
该研究获国家自然科学基金资助。
论文链接:https://www.pnas.org/doi/10.1073/pnas.2403038121
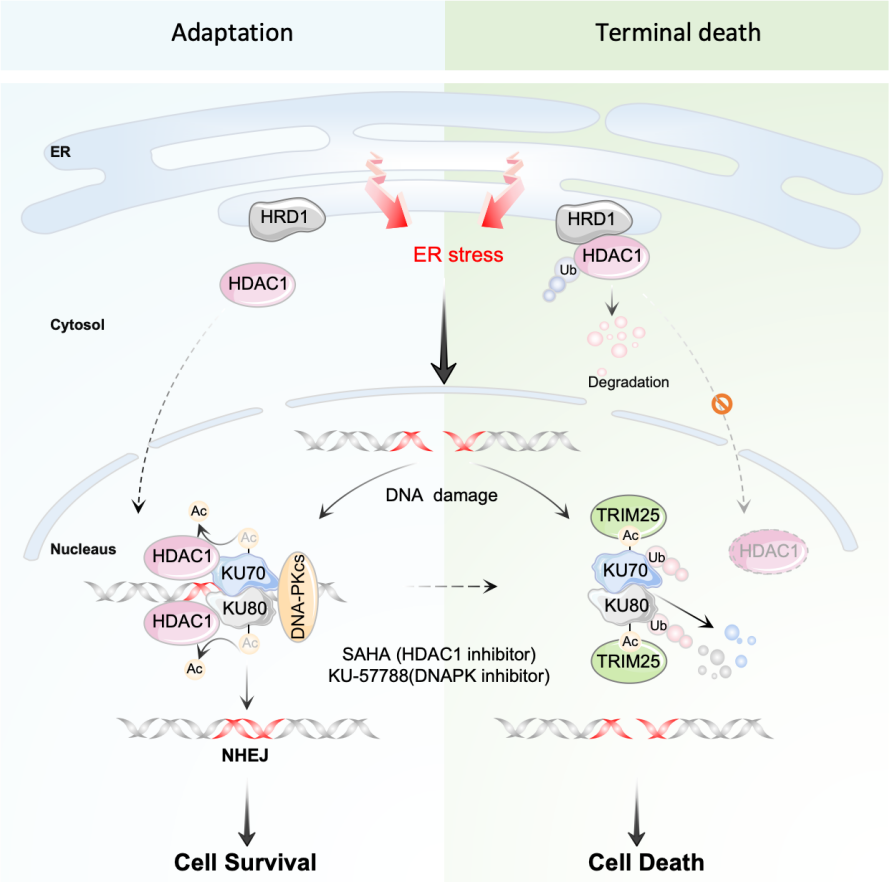
ER Stress与DDR串扰新机制:内质网相关降解连接酶HRD1调节DNA-PKcs-NHEJ活性的分子机制
责任编辑:梁英爽
审核:宋玲 李守斌
