LysoPS是一种脂质介质,通过与特定的G蛋白偶联受体(包括GPR174、GPR34、P2Y10)结合诱导多种细胞反应,这些受体被称为溶血磷脂酰丝氨酸受体。其中,GPR174主要在分化和成熟的调节性T细胞(Treg)中大量表达并同时负调控Treg细胞积累。GPR174也抑制白细胞介素-2和CD4T细胞的产生。GPR174的主要功能是调节免疫反应,因而是重要的炎症和自身免疫疾病的靶点。P2Y10的表达主要在脾脏、胸腺和淋巴结这些免疫器官内。P2Y10介导外周血的嗜酸粒细胞的去粒化,是潜在嗜酸粒细胞相关疾病,比如哮喘疾病的治疗靶点。GPR34在肥大细胞和小胶质细胞中高表达,并与神经性炎症和痛觉有关。GPR174的功能主要通过与G蛋白偶联实现,GPR174能同时与Gs和G12/13偶联,但主要与Gs偶联。
基于溶血磷脂酰丝氨酸在免疫反应中的重要作用和潜在对炎症及自身免疫疾病的治疗可能性,何元政课题组运用冷冻电镜技术解析天然配体LysoPS与人GPR174以及Gs蛋白复合物结合的冷冻电镜结构。该结构揭示与其他溶血磷脂受体识别机制差异很大的独特配体识别模式,主要表现为LysoPS的负电荷头部基团可与周围配体结合口袋的关键残基形成广泛极性相互作用,使L-丝氨酸深埋入配体结合口袋中的正电荷空腔中。在该结构中发现一个部分开放的口袋,通过跨膜结构域螺旋4(TM4)和跨膜螺旋5(TM5)朝向脂质双分子层,使配体便于横向进入。此外,该结构还揭示一种独特的Gs接合模式,即螺旋5(αH5)尖端深入到GPR174胞腔内部,因此,受体与αH5之间可形成广泛的极性相互作用,这是从前Gs偶联受体结构中没有报道过的现象。
何元政课题组博士研究生梁佳乐、日本东北大学药理学研究生院井上飞鸟教授为并列第一作者。何元政研究员和井上飞鸟教授为共同通讯作者。何元政课题组博士研究生夏瑞雪、王娜、徐珍媚、钱雨、祝鑫焱,日本东北大学药理学研究生院生田达也博士参与该课题的研究工作。
论文链接:https://www.nature.com/articles/s41467-023-36575-0
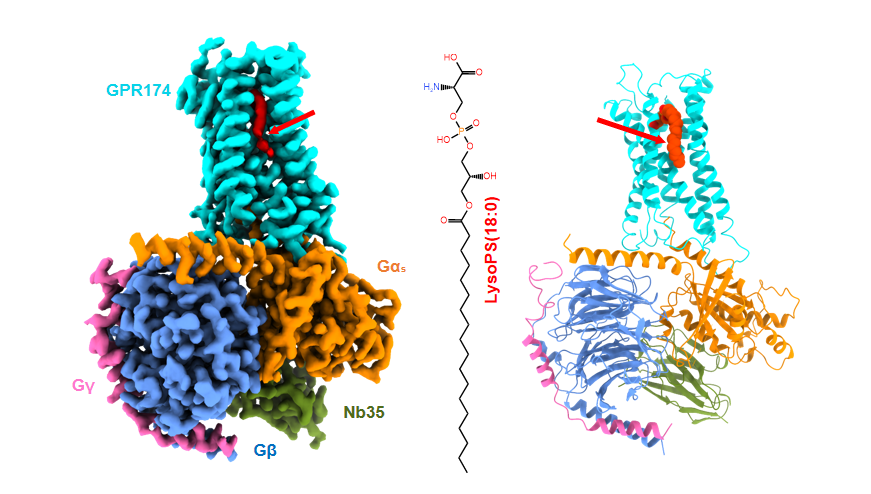
GPR174/GS蛋白复合物冷冻电镜结构
责任编辑:梁英爽
