11月15日,中国科学院生物物理研究所方显杨研究组与清华大学生命学院陈春来课题组合作,在《自然·通讯》(Nature communications)在线发表了题为“翻译调控型T-box核糖开关折叠与tRNA识别耦联的结构与动态机制”(Structural and dynamic mechanisms forcoupled folding and tRNA recognition of atranslational T-box riboswitch)的研究论文。研究中,研究人员整合应用小角X射线散射(SAXS)技术、单分子荧光共振能量转移(smFRET)技术以及分子动力学模拟,探究了来自皮疽诺卡氏菌(Nocardia farcinica)的特异性识别异亮氨酸的ileS T-box核糖开关适配体结构域(包含stem I, stem II和stemIIA/B茎环元件)在溶液中的折叠与构象动态,揭示了由镁离子及ileS-tRNA结合调控的T-box核糖开关适配体结构域的折叠动态过程和相应的自由能面,为深入理解RNA-RNA相互作用对RNA折叠与识别的重要影响以及发展和理性设计靶向RNA的新型抗生素药物提供了理论依据。
研究中,为实现对T-box核糖开关适配体结构域的多对位点荧光探针标记(dense labeling)进而利用smFRET技术全面研究其构象动态,方显杨研究组设计并化学合成了碱基被炔基修饰的NaM非天然核苷酸NaM(NaMCO),结合研究组此前设计合成的碱基被氨基修饰的TPT3非天然核苷酸(TPT3A),发展了基于非天然碱基系统(NaM-TPT3)的长链RNA位点特异性荧光探针正交标记技术(图1)。通过重叠延伸PCR以及体外转录,可向RNA的特定位点引入化学修饰的非天然碱基(NaMCO, rTPT3A),随后通过点击化学以及NHS酯基与氨基的化学反应可将正交的荧光探针(如Cy3, Cy5)与非天然碱基相耦联,从而实现对RNA的位点特异性荧光标记。该方法突破了传统RNA位点特异性标记技术如化学合成等在RNA长度、标记位点、标记效率及对结构的干扰等方面的局限性,将极大推动和拓展smFRET技术在研究长链RNA构象动态以及解析其三维结构中的应用。
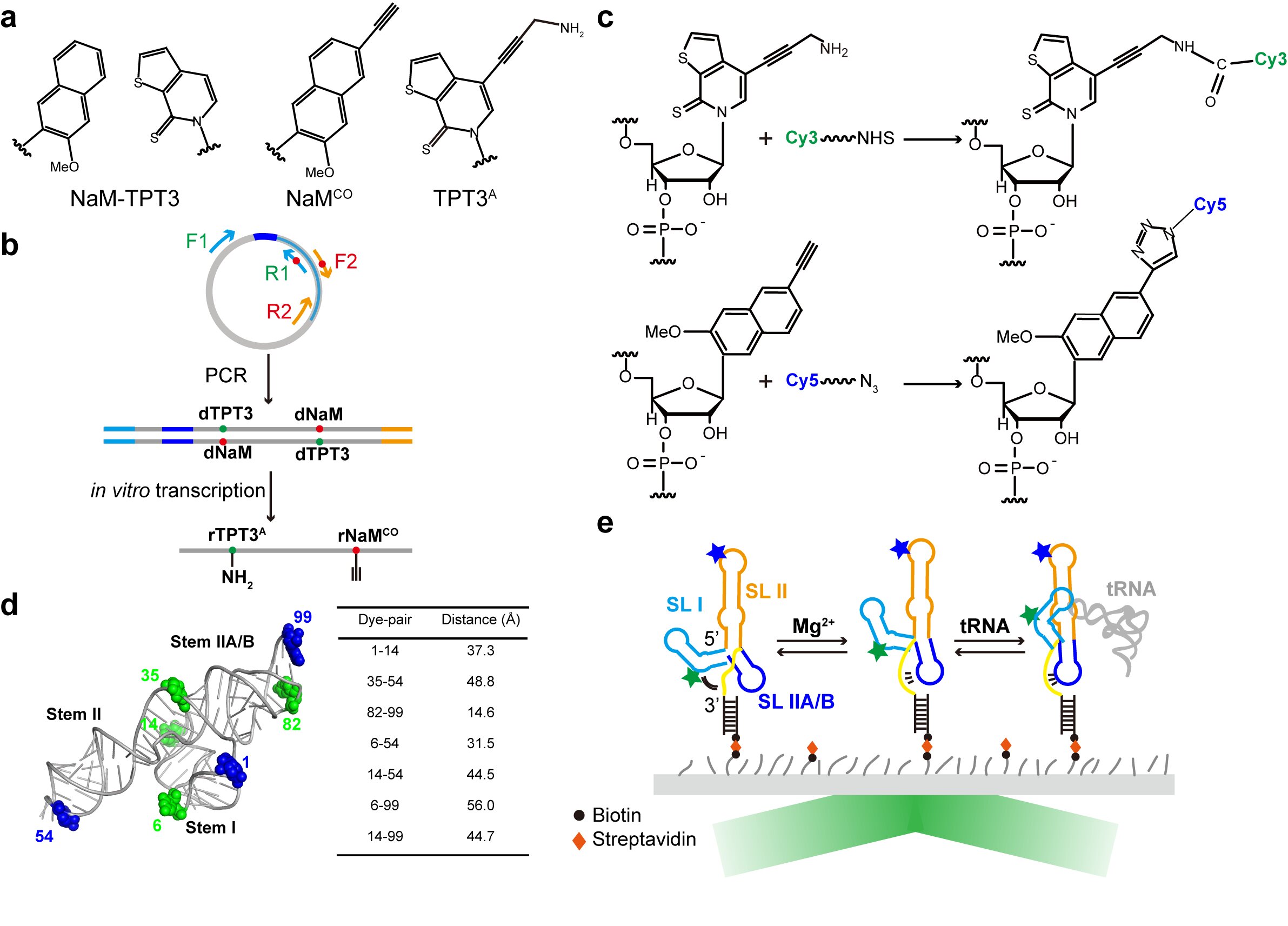
图1. 基于非天然碱基系统的RNA位点特异性荧光标记技术
利用基于非天然碱基系统的位点特异性正交荧光标记策略,研究人员在T-box核糖开关适配体结构域上选择了七对标记位点,构建了一个密集的标记网络,得以全面的探究tRNA及镁离子诱导的T-box核糖开关适配体的构象动态。研究发现,镁离子可以稳定stemIIA/B假结结构,使其与stemII结构域共轴堆积,进而诱导stemI与stemII结构域的预对接,使T-box折叠为可以结合tRNA的活性构象,而tRNA的结合则进一步诱导了stemI与stemII结构域的对接。此外,研究者也利用SAXS技术结合分子动力学模拟建立了T-box核糖开关不同长度的转录中间产物(T77, T89)在不同镁离子条件下的溶液结构模型,并结合突变实验进一步证实了stemIIA/B假结结构以及S-turn结构基序在T-box识别tRNA过程中的重要作用。综合上述实验结果,研究者们提出了镁离子及tRNA介导的T-box核糖开关适配体的共转录折叠模型(图2),揭示了在转录过程中T-box核糖开关各个结构元件相互协同调控促进其折叠,最终保证其能高效、快速识别tRNA的分子机制。总的来说,该工作揭示了镁离子以及分子内或分子间的RNA-RNA相互作用之间的微妙平衡在调控T-box核糖开关折叠以及功能中的作用。
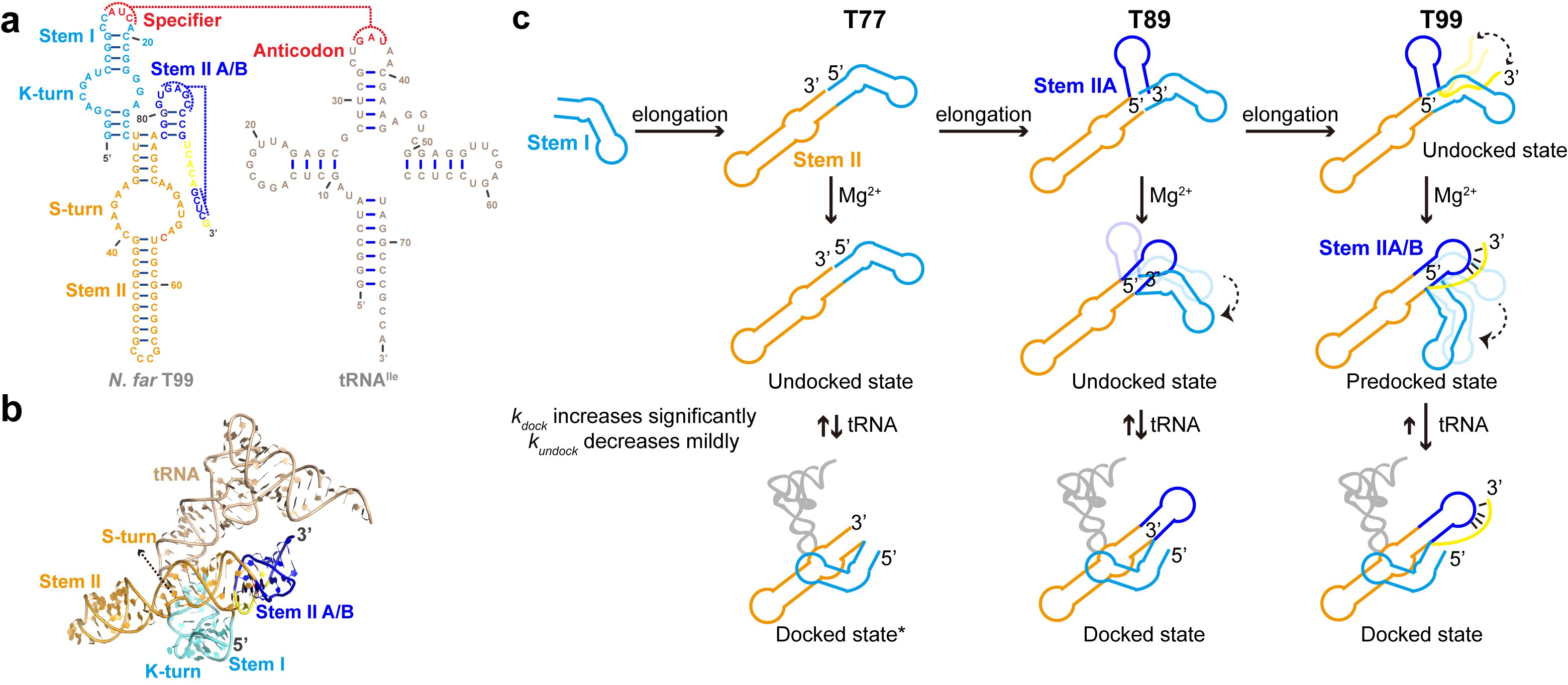
图2. 镁离子及tRNA介导的翻译型T-box的折叠模型
中国科学院生物物理研究所方显杨研究员与清华大学生命学院陈春来副教授为该论文的共同通讯作者。清华大学生命学院博士后牛晓林为该论文的第一作者。清华大学生命学院2017级博士生徐钟河,方显杨研究组研究助理张宇帆为研究工作作出了重要贡献;美国阿贡国家实验室左孝兵博士收集了SAXS数据。研究得到国家自然科学基金委、中科院先导项目B、北京市生物结构前沿研究中心、中国博士后科学基金以及清华大学“水木****”计划的经费支持。
论文链接:
https://doi.org/10.1038/s41467-023-43232-z
供稿:生命学院
编辑:李华山
审核:郭玲
2023年11月22日 16:10:25
