基于这个思路,清华大学生命科学学院魏迪明分子设计课题组(MADlab)研究探索了一种可控的DNA纳米结构自组装系统。与Golden Gate assembly中多片段DNA组装相似,IIS型限制酶为DNA纳米结构的连接创造特异的粘性末端,同时T4 DNA连接酶巩固粘性末端的连接,从而实现DNA纳米结构单元不同层级的自组装(图1)。
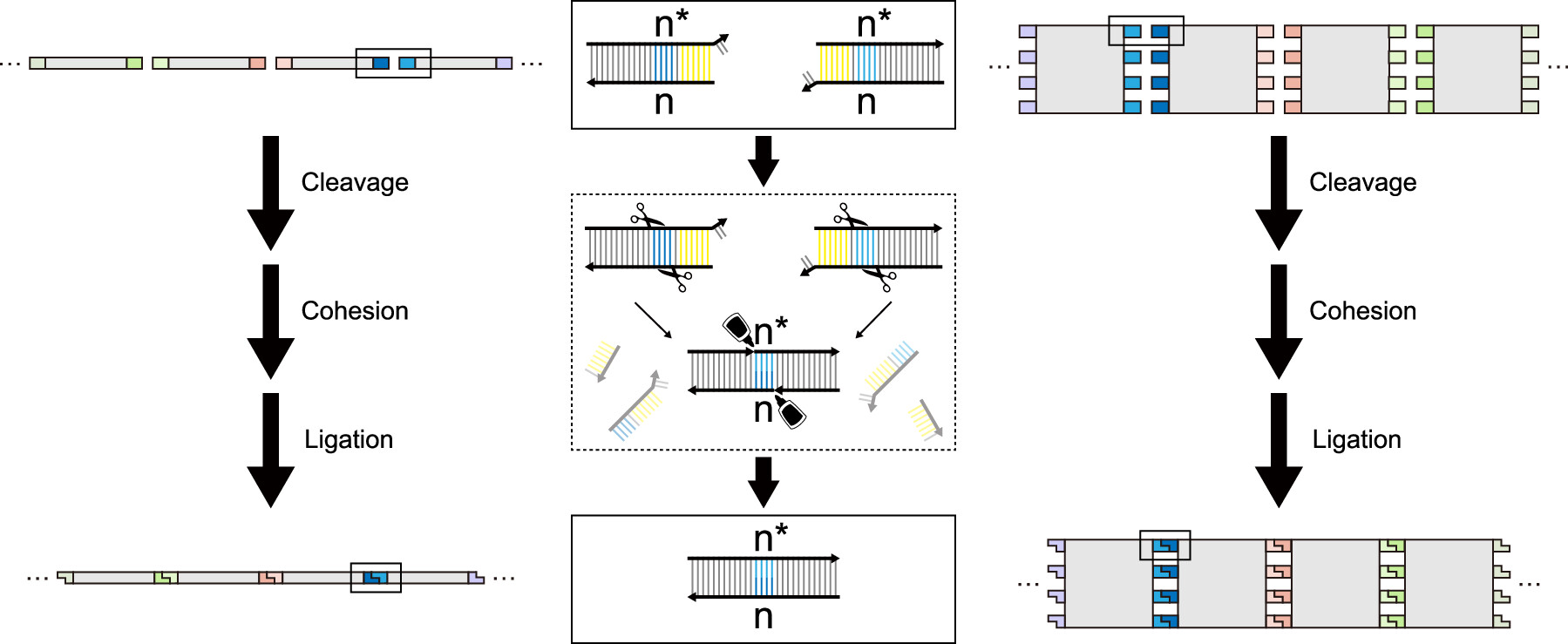
图1. Golden Gate assembly用于DNA片段(左)和DNA纳米结构(右)组装
利用IIS型限制酶和T4 DNA连接酶的特点,该研究实现了DNA纳米结构的自环化、同源多聚体以及包括二聚体、三聚体、四聚体和五聚体在内的多种异源多聚体的组装(图2)。
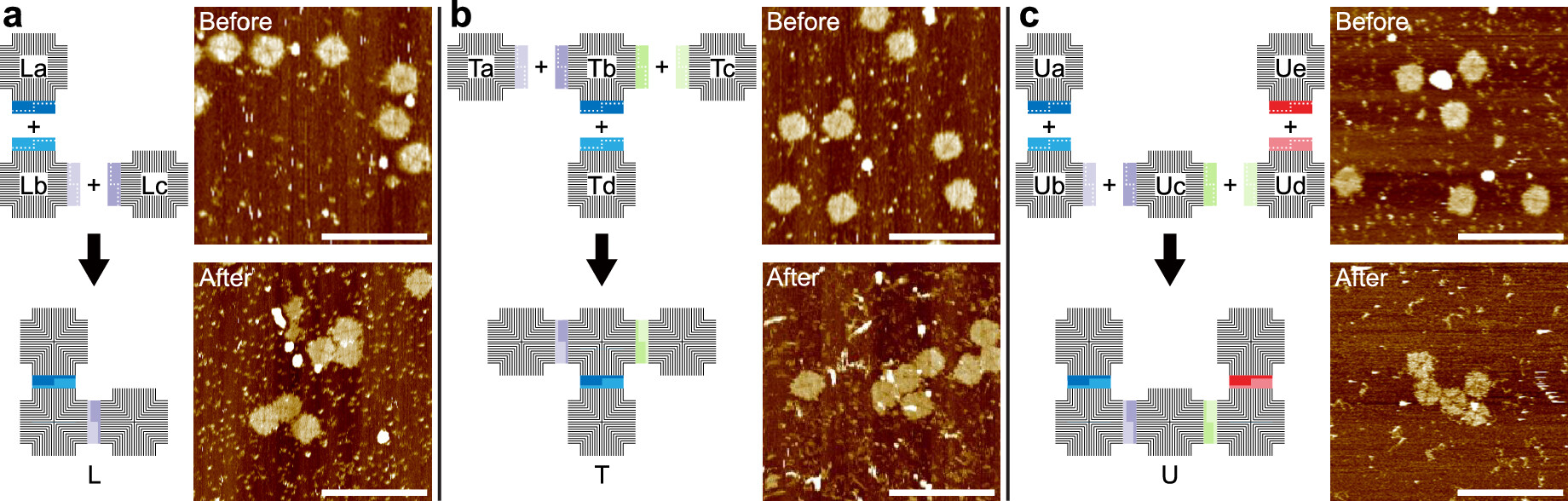
图2.Golden Gate assembly用于DNA纳米结构异源多聚体组装。(a)三聚体L形,(b)四聚体T形,(c)五聚体U形
相关研究成果以“DNA纳米结构的金门桥组装”(Golden Gate Assembly of DNA Nanostructures)为题,于11月14日在线发表于《美国化学学会材料快报》(ACS Materials Letters)。
清华大学生命科学学院本科毕业生张文远(现为清华大学医学院2022级博士研究生)和生命学院2018级博士生午红蕊为论文共同第一作者,魏迪明副教授为论文通讯作者。该研究源于本科生课程“核酸纳米结构的分子设计”中的其中一个课程项目(张文远为该课程项目小组长)。研究得到科技部、国家自然科学基金委、清华大学春风基金等的资助。
论文链接:
https://pubs.acs.org/doi/10.1021/acsmaterialslett.3c01113
供稿:生命学院
编辑:李华山
审核:郭玲
2023年11月17日 14:06:47
