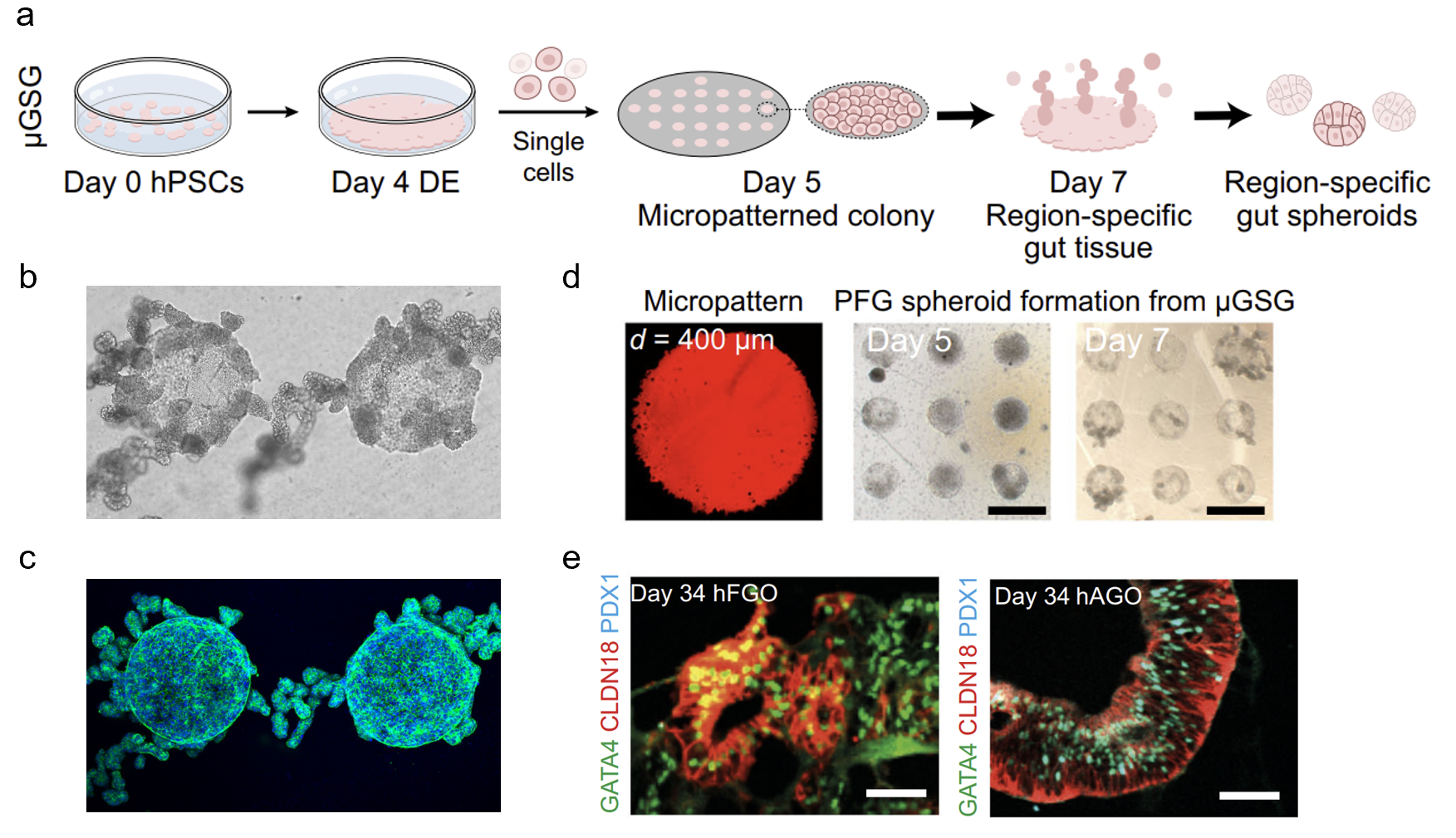
图1.(a)μGSG构建内胚层来源类器官的流程示意图;(b)类器官前体出芽发生的明场图;(c)类器官前体出芽发生的荧光图;(d)微图案荧光图及类器官前体发生过程的明场图;(e)对μGSG产生前体长时程培养(Day34)的免疫荧光染色鉴定
近日,清华大学航天航空学院工程力学系生物力学与医学工程研究所邵玥副教授、李博副教授课题组在期刊《自然·通讯》(Nature Communications)上在线发表了题为“力学增强的消化道类器官构建及其失稳驱动的形态发生机制”(Mechanically enhanced biogenesis of gutspheroids with instability-drivenmorphomechanics)的研究论文,报道了一种力学调控、通用、高效的消化道类器官构建体系μGSG(micropatterned gut spheroidgenerator)(图1)。该体系基于微限域培养方法,可以大幅提高胃、肠、肺、食道等多种区域特异化类器官的生产效率。利用μGSG所构建的类器官,具有和传统方法一致的仿生度,却突破了传统方法效率低、可重复性差、且无法标准化生产的瓶颈,或将有力促进消化道类器官构建技术的发展与应用。
进一步研究结果表明,μGSG提高类器官形态发生效率的机制不依赖于细胞培养的几何边界条件(即微图案的形状和尺寸),呈现出与传统理论不同的规律。通过结合实验观测和活性相场理论模型,发现通过机械力诱导的细胞聚集及多层堆叠是促进类器官高效生成的必要条件,并揭示了力学失稳(instability)是驱动由干细胞发育而来的消化道组织出芽(budding)、成球(pearling)、断裂(fission)的形态力学机制,成功预测了实验所观测到的单分散类器官形态,并利用生物力学相图刻画了组织表面张力调控的形态发生过程(图2)。总体上,这项工作揭示了组织表面张力和力学失稳调控组织形态发生的力-生物耦合新范式,为类器官构建与深入研究组织形态发生的机制提供了新方法和新思路。
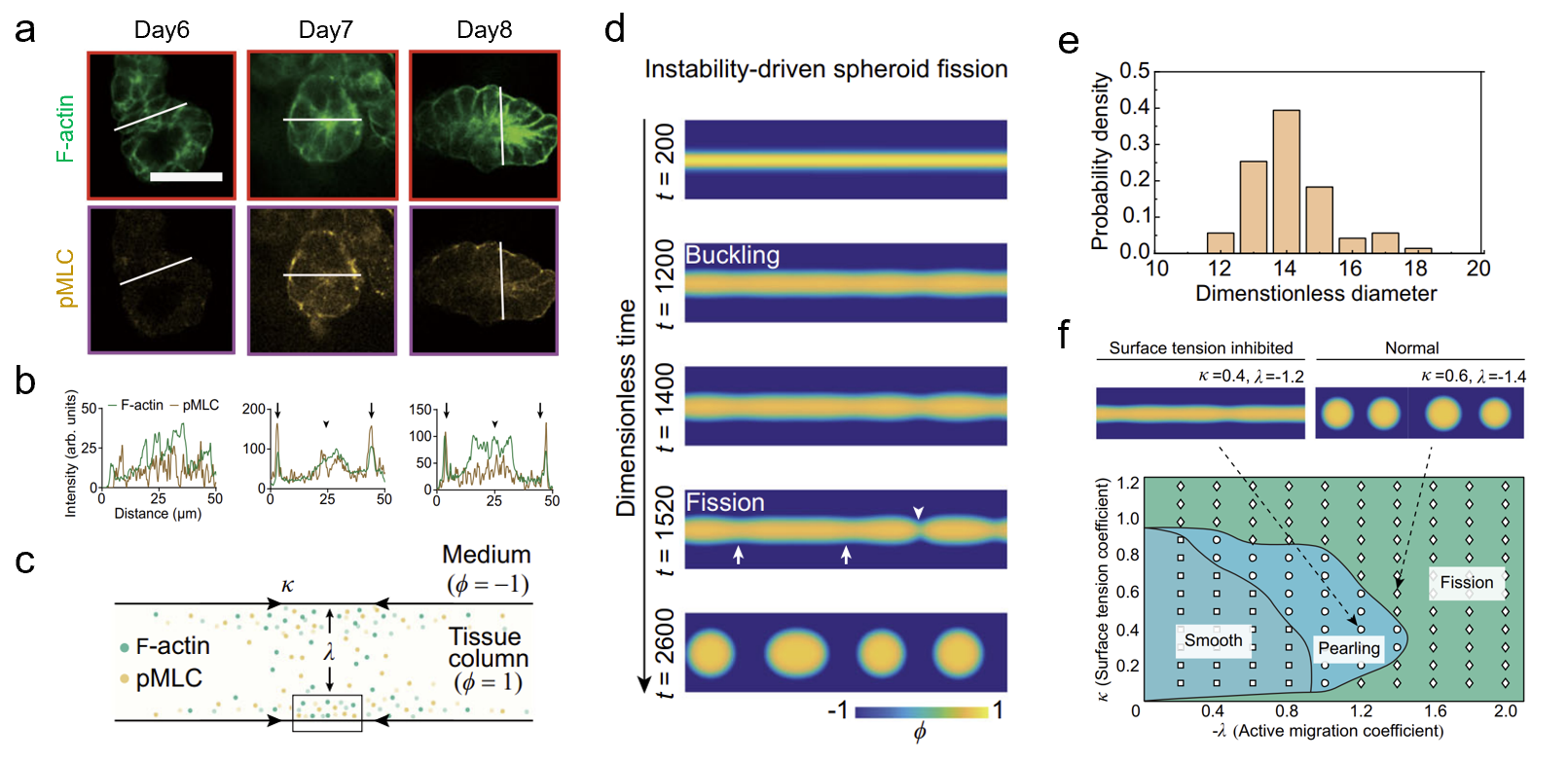
图2.力学失稳驱动的类器官形态发生机制:(a)组织柱断裂前不同天数的细胞骨架免疫荧光染色图;(b)组织柱断裂前不同天数的细胞骨架的荧光分布统计;(c)前体球形态发生的活性相场模型示意图;(d)组织柱断裂产生前体球的模拟结果;(e)通过活性相场模型预测前体球大小;(f)前体球不同形态发生阶段的相场图
邵玥副教授与李博副教授为论文的通讯作者。中国科学院大学温州研究院林峰副研究员、清华大学航天航空学院博士后李夏、密歇根大学安娜堡分校博士研究生孙诗语、清华大学航天航空学院博士研究生李钟艺为论文的共同第一作者。密歇根大学安娜堡分校傅剑平教授也参与了研究。该研究得到国家自然科学基金区域创新发展联合基金重点支持项目、国家自然科学基金创新群体项目、国家自然科学基金青年项目、清华大学笃实专项等的资助。
论文链接:
https://www.nature.com/articles/s41467-023-41760-2
供稿:航天航空学院
编辑:李华山
审核:郭玲
2023年10月17日 10:14:52
