基因表达的精准调控是保证正常发育和维持组织稳态的基础。目前已知许多基因调控蛋白(如转录因子、 组蛋白、表观调控因子等)在肿瘤中频繁突变,且这些突变能够驱动原癌基因表达,但是具体的分子机制在很多情况下依然不清楚。Eleven-Nineteen-Leukemia(ENL)蛋白是一类表观调控因子,可以通过其氨基端的YEATS结构域特异识别组蛋白乙酰化修饰,从而招募组蛋白甲基转移酶DOT1L或者超级延伸复合物SEC等促进下游靶基因的转录。2014年,李海涛与石晓冰实验室在《细胞》期刊发表合作文章,首次揭示YEATS结构域是一类全新折叠类型的组蛋白酰基化读码器。随后围绕人源四个YEATS家族蛋白(AF9,ENL,YEATS2,GAS41),李海涛实验室与合作者开展了一系列结构与功能研究,阐明了YEATS家族成员在巴豆酰化、苯甲酰化等非乙酰化酰基化识别,以及肿瘤发生、炎症反应、干细胞分化等过程中的机制和作用,并实现了数个小分子抑制剂的开发。ENL是混合谱系白血病(Mixed lineage leukemia, MLL)染色体异位发生基因融合的常见伙伴基因,由此引发的白血病在幼儿病患中很常见且比较恶性,预后效果差。同时,外显子组测序在肾母细胞瘤(Wilms tumor)、乳腺癌、肺癌等病患样本中发现了多种类型的YEATS结构域基因突变。万里玲与合作者于2017和2019年在《自然》期刊先后发表两篇文章,分别揭示ENL是驱动急性白血病发生的关键因子,并证明ENL的YEATS结构域是一类重要的治疗急性白血病的药物靶标;以及发现ENL YEATS热点突变通过增强ENL自我聚集促进其在靶基因的富集,进而激活原癌基因并导致癌症发生。
李海涛实验室与万里玲实验室合作在《分子细胞》(Molecular Cell)期刊发表封面文章“结构性ENL YEATS结构域热点突变关联异常转录凝聚体与癌症”(Hotspot mutations in the structured ENL YEATS domain link aberrant transcriptional condensates and cancer)。文章中,研究者系统运用结构生物学、生物化学、细胞生物学等手段揭示出表观因子ENL热点突变通过引发异常转录凝聚体促癌的分子病理机制。该工作首次发现“脯氨酸凸起”结构基序在读码器结构域ENL YEATS中具有抑制异常相分离进而防止癌症发生的作用。在这项刚发表的研究工作中,李海涛和万里玲研究团队通力合作,深入探讨了YEATS热点突变导致ENL在靶基因上异常富集的结构基础和相变机制。
肾母细胞瘤中,代表性ENL致癌突变(oncogenic mutation)(T1-T8)集中在YEATS结构域的β8折叠股(β8 strand)一端。且根据突变类型,可以分为插入型(T1、T4、T7、T8)和缺失型(T2、T3、T5、T6)两大类。为了阐明突变带来的结构变化,作者解析了4个突变体的YEATS结构域与H3K27ac多肽的复合物晶体结构(插入型:T1和T4;缺失型:T2和T3)。结果显示,突变体整体结构与野生型相比基本一致,突变的产生并没有破坏YEATS结构域的折叠,且保留了组蛋白乙酰化的识别能力。那么这些致癌突变体的共性特征是什么呢?经过基于结构的深入分析,研究人员发现上述一系列插入或删除的突变均导致:b8折叠股(b8-strand)末端“脯氨酸凸起”(PP-bulge)结构基序(motif)的消除。在野生型YEATS结构域中,β8折叠股氨基末端存在一类串联脯氨酸“PP”基序,该基序被大量氢键网络所稳定形成一个凸起结构,封闭和保护了β8折叠股末端。在突变体YEATS中,这个凸起结构或被移走(插入突变)或消除(缺失突变),从而造成了β8折叠股的延伸和暴露。晶体堆积提示,延伸后的β8可以利用其暴露出的β-边沿(β-edge)介导YEATS结构域之间的“β-β”片层堆垛,进而增强了原本微弱的YEATS之间的自聚集。而野生型中的“脯氨酸凸起”结构基序则与这种互作不兼容,抑制了自聚集发生。
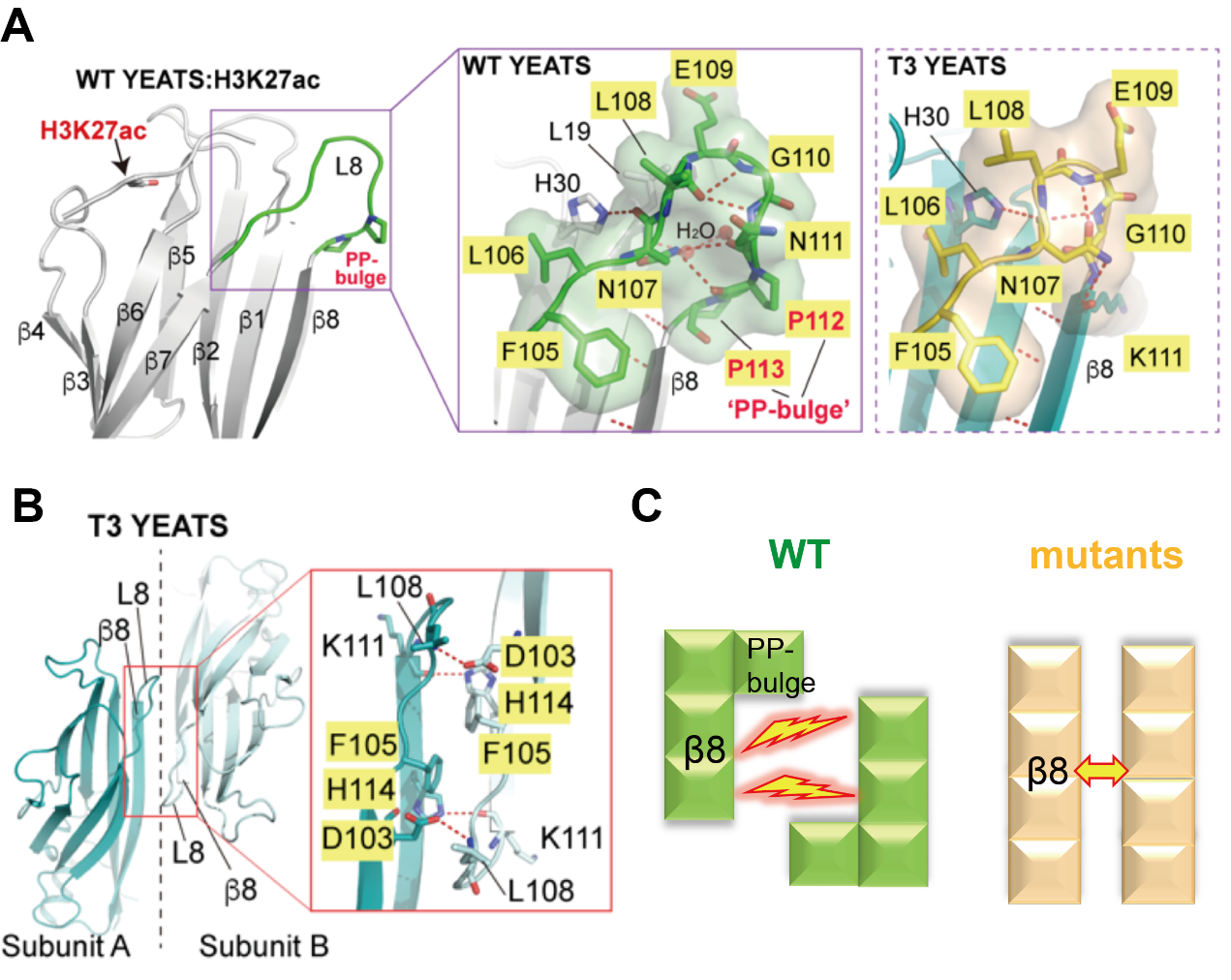
图1.致癌突变体导致“脯氨酸凸起”移走/消除,促进异常相分离发生。A)野生型蛋白中,YEATS结构域β8末端的脯氨酸被大量氢键网络稳定,形成“凸起”,该结构在突变体中被移走或消除。B)突变体利用其延长的β8增强YEATS结构域自聚集。C)野生型YEATS中的“脯氨酸凸起”抑制了自聚集
那么这些致癌突变的功能后果是什么呢?为了回答这个问题,研究人员在肾细胞系中表达了与内源水平相近的野生型和突变型Flag-ENL。在内源表达水平下,ENL突变体(T1-T8)可以形成亚微米级(~400 nm)的凝聚体,而且这些凝聚体与靶基因(e.g., HOXA11/13)的新生RNA共定位。与野生型相比,肿瘤突变增加了ENL在靶基因处的富集并增强了其转录活性,进而导致肿瘤发生。有趣的是,研究人员在β8末端重新引入一个脯氨酸,从而在突变体YEATS中重构了“脯氨酸凸起”障碍。体外和体内实验也发现这一微小突变几乎彻底消除了肿瘤突变引起的凝聚体以及靶基因过表达。这些结果首次表明蛋白“有序”结构域的癌症突变可以诱导异常凝聚体在体内形成,并揭示出ENL YEATS的“脯氨酸凸起”结构基序在抑制癌症发生中的重要作用。
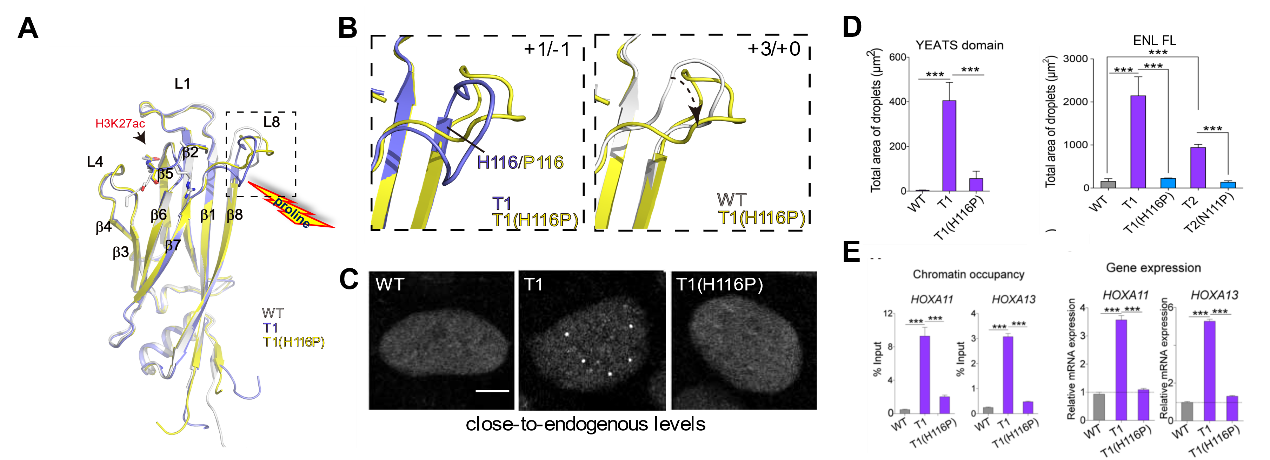
图2.单点突变重构“障碍”,逆转致癌突变体功能。A,B)致癌突变体上引入单点突变(β8末端组氨酸替换为脯氨酸)恢复了被延长的β8,并重构了“脯氨酸凸起”障碍。C,D)引入的脯氨酸突变在体内体外均有效抑制了致癌突变导致的异常凝聚体形成。E)并减少了其在靶基因上的聚集,抑制靶基因过表达
相分离往往由多价相互作用所介导,涉及到复杂而精细的分子机制。通过构建一系列的截短体,研究者发现除了氨基端YEATS结构域,ENL蛋白的其他区域,包括中间的内在无序区(IDR)和羧基段的AHD结构域,对凝聚体的形成也很重要。目前已知很多蛋白的相分离依赖于IDR。ENL的IDR中富含丝氨酸,且根据氨基酸电荷属性,可以被分成富含正电荷的IDR1和富含负电荷的IDR2。根据这些特征,通过构建多个IDR1/2截短体以及电荷和丝氨酸的突变体。研究人员揭示了IDR1和IDR2在凝聚体形成中发挥着不同但互补的作用:IDR1调控凝聚体的初始形成, 而IDR2调控凝聚体的大小。更重要的是,针对IDR特征设计的一系列突变减弱了凝聚体的形成频率或大小,同时也抑制了肿瘤突变引起的异常转录功能。这些发现再次证实了异常转录凝聚体与功能之间的因果关系。
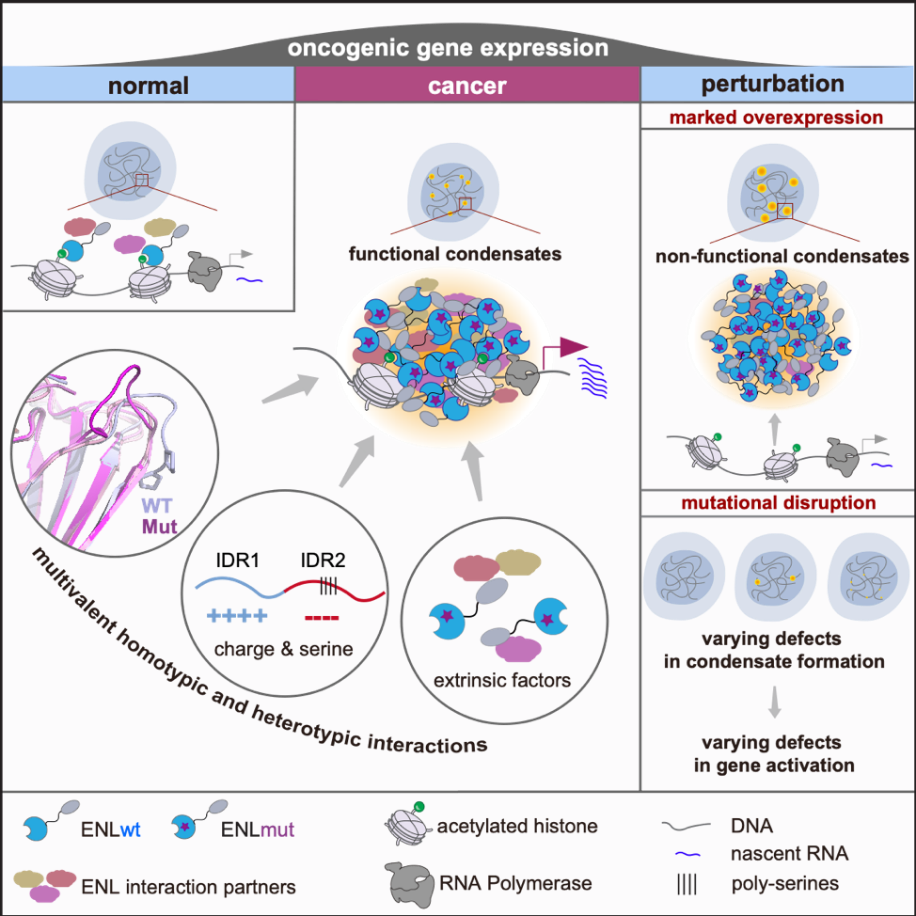
图3.ENL突变体多区域协同互作促进异常凝聚物形成,从而导致癌症发生
此外,ENL通过其AHD区域与多个转录调控因子(SEC,DOT1L等)相互作用并参与转录延伸。研究人员通过细胞成像技术和ChIP-qPCR实验发现通过凝聚体形成,ENL癌症突变可以导致大量调控因子富集在靶基因上。同时,通过构建一系列AHD点突变,作者发现打破ENL与SEC/DOT1L的相互作用显著减弱了凝聚体的形成并且抑制了下游靶基因转录延伸。这些发现表明在内源表达水平下,ENL突变体与其他调控因子的互作对凝聚体在靶基因上的形成也很重要。
值得一提的是,目前大部分有关凝聚体形成机制及其功能的研究都基于体外或者细胞内蛋白过表达系统,因此无法严谨地将凝聚体和靶基因的转录直接联系起来。作者发现,不同于拟生理条件,在过度表达情况下,ENL肿瘤突变体可以形成更大的液滴状凝聚体。然而,两种表达条件下形成的凝聚体的特征却显著不同:后者高度动态并且不依赖于与其他调控因子的互作。而且在过表达条件下,大的液滴状凝聚体不但不与靶基因共定位,并且可以抑制凝聚体在靶基因上的形成,从而抑制了肿瘤突变引起的靶基因过度表达。这些研究表明在不同的蛋白表达水平条件下,凝聚体形成的分子机制,其属性特征,以及功能都有可能不同。这些发现强调了在近内源表达条件下研究凝聚体机制和功能的必要性,为这个领域的研究方法提出了警钟和启示,也为控制致病凝聚体提供了新思路。
宾夕法尼亚大学博士后宋乐乐、清华大学医学院2020级博士生姚欣仪为本文并列第一作者。宾夕法尼亚大学万里玲助理教授、清华大学医学院李海涛教授和李元元博士为本文共同通讯作者。本工作得到了国家蛋白研究中心(上海)、清华大学细胞影像平台以及清华大学X-ray晶体学平台的大力支持与帮助。
论文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(22)00955-8
供稿:医学院
编辑:李华山
审核:郭玲
2022年11月16日 10:35:07
