研究人员发现,药物长时间的溶液过饱和常常和溶液中的载药纳米物质相关,然而这些载药纳米物质的形成机制尚不明确。不同研究人员根据不同的实验观察和研究角度,对此提出了两种可能的机理:一是ASD在介质中快速溶出,产生的过饱和溶液经过液-液相分离 (LLPS),产生富含药物的油滴形成纳米物质,其可作为药物储库维持药物过饱和;二是ASD中亲水性高分子溶出过快,导致剩余的富含药物组分形成纳米物质。
近日,清华大学药学院钱锋教授课题组提出了无定形固体分散体制剂工作的新机制和设计原则。该研究提出了一个全新的机理,即纳米物质的形成是由于存在“防水”的药物-高分子相互作用。该研究以非洛地平为模型药物,PVP、PVP-VA及HPMC-AS为高分子制备了5%-20%载药量的ASD,并比较了它们在0.05M HCl与PBS (pH6.5)介质中的固有溶出行为,其中部分过饱和的溶出介质产生了纳米物质。同时,对非洛地平与这三种高分子的相互作用展开研究,结果表明存在“防水”的药物-高分子相互作用的ASD倾向于在溶出时产生纳米物质。
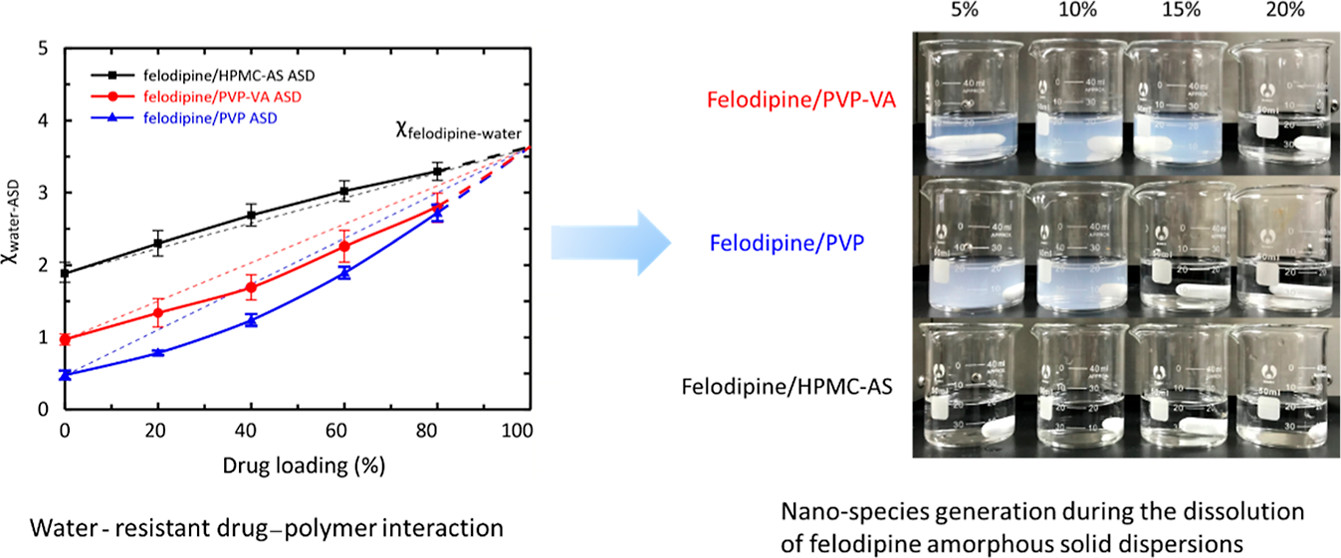
图1.“防水”的药物-高分子相互作用与ASD在0.05M HCl中产生纳米物质的示意图
ASD中的高分子通常有以下两种作用:一是结晶抑制剂,抑制存储过程中无定形药物发生结晶;二是维持溶出过程中的过饱和,促进药物的吸收。在这个过程中,药物-高分子相互作用起到重要作用。采用DSC,测得非洛地平与PVP、PVP-VA与HPMC-AS的Flory-Huggins相互作用参数分别为-0.55±0.20,-1.02±0.21及0.62±0.07。负值的Flory-Huggins相互作用参数说明两者存在吸引相互作用,而正值则说明相互作用为排斥。进一步采用NMR研究两者的相互作用,非洛地平的相对位移变化值参见图2。结果表明,非洛地平与PVP、PVP-VA产生相互作用的位点稍有不同;VA基团使PVP-VA比PVP更易与非洛地平产生氢键。
同时,采用了动态水吸附(DVS)研究了非洛地平ASD中药物与高分子在水分存在时的相互作用,结果详见图1中左图。PVP与PVP-VA ASD中,水分的存在有助于两组分的相互作用(曲线下凹),而HPMC-AS ASD中,水分的存在会破坏药物高分子的相互作用(曲线上凸)。这一实验现象与观察到的纳米物质的产生,具有一定的相关性。
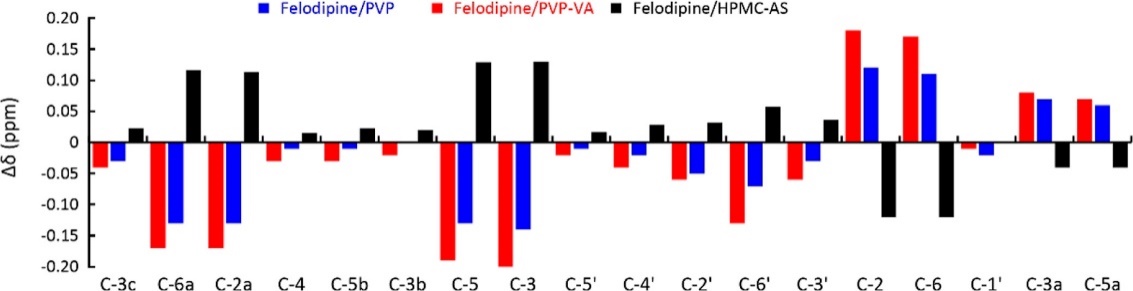
图2.非洛地平在高分子存在时的13C NMR化学位移变化值
本研究工作得到如下结论,即“防水”的药物-高分子相互作用是溶出过程中纳米物质形成的原因。该研究在ASD制剂应用领域具有重要的应用:这一机制直接将纳米物质的形成与高分子的选择联系起来,提供了纳米物质产生的直接物理化学机理,还提出了一种设计ASD处方以优化药物溶出和口服生物利用度的潜在方法。
以上内容由清华大学药学院钱锋课题组和德国拜耳制药公司的研发人员联合发表于物理药剂学国际期刊《分子药剂学》(Molecular Pharmaceutics),题为“防水的药物?聚合物相互作用有助于非洛地平无定形固体分散体在溶出过程中形成纳米物质”(Water-Resistant Drug?Polymer Interaction Contributes to the Formation of Nano-Species during the Dissolution of Felodipine Amorphous Solid Dispersions)。
清华大学药学院钱锋教授为本文通讯作者,钱锋教授课题组博士后刘磊为本文的第一作者,德国拜耳公司的科研人员林克·陈(Linc Chen)、乌特·穆勒斯(Wouter Müllers)、皮特·塞尔诺(Peter Serno)为共同作者。德国拜耳公司为本项研究提供了资金支持,寻济生物科技(北京)有限公司为刘磊的博士后培训提供部分资金。
论文链接:
https://pubs.acs.org/doi/10.1021/acs.molpharmaceut.2c00250
供稿:药学院
编辑:李华山
审核:吕婷
2022年11月04日 11:50:27
