
 , 惠淑君1, 郭华明1, 连国玺2, 武旭阳2, 孙娟2
, 惠淑君1, 郭华明1, 连国玺2, 武旭阳2, 孙娟21. 中国地质大学(北京)生物地质与环境地质国家重点实验室, 北京 100083;
2. 中核第四研究设计工程有限公司, 石家庄 050021
收稿日期: 2020-03-09; 修回日期: 2020-05-05; 录用日期: 2020-05-05
基金项目: 中核集团集中研发项目(中核科发(2018)111号)
通讯作者(责任作者): 杨冰(1988-), 男, 工程师(博士研究生), E-mail:yangb58@163.com
摘要:天然含水层介质对铀的吸附是地下水铀天然衰减的决定因素.然而,人们对天然含水层砂岩吸附铀行为的认识相当有限.因此,本文采用静态实验及数值模拟相结合的方法研究了地浸井场外围砂岩对铀的吸附行为,探究了天然砂岩对溶液中铀的吸附动力学和等温吸附特征,研究了铀初始浓度、pH、其他离子种类与浓度对铀吸附的影响.结果表明,准二级动力学方程与Freundlich等温吸附模型可以更好地表征砂岩对铀的吸附行为;随着溶液中铀初始浓度的增大,砂岩对水溶液中铀的吸附量增大,吸附率减小;在初始pH=3时,铀的吸附率达到最大,为77%;砂岩对溶液中铀的吸附率会随反应体系中Ca2+、Mg2+、SO42-、HCO3-等离子浓度的升高而下降,4种共存离子对该吸附过程抑制能力的顺序为:SO42- < Mg2+ < Ca2+ < HCO3-.这些研究结果可为地浸铀矿山地下水的修复提供理论支持.
关键词:地下水砂岩铀吸附动力学等温吸附
Adsorption of uranium on aquifer sandstone obtained near in-situ leaching uranium mine
YANG Bing1,2

 , HUI Shujun1, GUO Huaming1, LIAN Guoxi2, WU Xuyang2, SUN Juan2
, HUI Shujun1, GUO Huaming1, LIAN Guoxi2, WU Xuyang2, SUN Juan21. State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences(Beijing), Beijing 100083;
2. The Fourth Research and Design Engineering Corporation of CNNC, Shijiazhuang 050021
Received 9 March 2020; received in revised from 5 May 2020; accepted 5 May 2020
Abstract: Uranium (U) adsorption on natural aquifer media is a vital process determining natural attenuation of groundwater U. However,less is known about U adsorption on aquifer sandstone. Adsorption of uranium on aquifer sandstone obtained near the in-situ leaching uranium mine was studied by using batch experiments and numerical simulation to characterize adsorption kinetics,isothermal adsorption,and effects of initial concentrations of U(VI),pH,major ions on U adsorption on the sandstone. The results showed that the quasi-second-order kinetic equation and Freundlich isothermal adsorption model well delineated the adsorption process of U on the sandstone. With the increase in initial U concentration,the amount of adsorbed U on the sandstone increased,but adsorption efficiency decreased. At initial pH around 3,the adsorption efficiency was the highest,which was up to 77%. Uranium adsorption on the sandstone decreased with the increase in concentrations of Ca2+,Mg2+,SO42-,and HCO3-. The order of the adsorption inhibition by coexisting major ions was shown as follows: SO42- < Mg2+ < Ca2+ < HCO3-. This study provides the theoretical supports for in-situ remediation of U-contaminated groundwater.
Keywords: groundwatersandstoneuraniumadsorption kineticsisothermal adsorption
1 引言(Introduction)砂岩型铀矿床是我国铀矿四大工业类型之一(阙为民等, 2005), 其铀矿资源量约占我国已探明铀矿资源总量的35%(代春艳等, 2014).原地浸出作为砂岩型铀矿开采的主流工艺(Mudd, 2001), 具有工艺简单、基建投资少、建设周期短、生产成本低、环境友好等优点(Zammit et al., 2014).所谓“原地浸出工艺”是指在矿石处于天然埋藏状况下, 将溶浸液通过注液井注入含矿层, 从矿石中选择性地溶出金属铀, 再利用抽液井将含铀溶液(浸出液)提升至地表的集采、冶于一体的新型铀矿开采方法.按照溶浸液的不同, 地浸采铀工艺可以分为酸法浸出(以H2SO4为主要溶浸剂)、碱法浸出(以NaHCO3为主要溶浸剂)和CO2+O2浸出.预计到2020年, 我国地浸工艺铀产量将占天然铀总产量的90%以上.
在地浸生产过程中, 由于溶浸液的注入, 含矿含水层的氧化还原环境及酸碱环境会发生改变, 造成井场区域地下水中铀等核素含量升高;同时, 由于铀兼具化学毒性与放射性毒性, 在生物体内富集后会导致肾损伤、致癌致畸等严重健康问题(徐佳丽, 2014;Corlin et al., 2016).因此, 在井场停产后必须选取经济、合理的地下水修复技术对地下水环境进行恢复治理.目前, 我国针对CO2+O2原地浸出采铀地下水修复技术尚未开展系统的科学研究, 没有成熟的工程实践.
自然衰减过程(Natural Attenuation Processes)已被证明可以有效降低地下水铀等污染核素的浓度(El-Naby et al., 2008;Zhu et al., 2008;Dong et al., 2016), 而吸附作用作为控制铀的迁移特性与长期归宿的重要自然衰减过程之一, 得到了越来越多的研究.但目前对铀的吸附行为的研究大多集中在单矿物吸附(崔瑞萍等, 2015;Reinoso-Maset et al., 2016;黄俊文等, 2019)或合成/改性材料的吸附(谢水波等, 2014;李仕友等, 2017;王芳等, 2018)等方面, 而针对井场外围砂岩这种天然介质对铀的吸附行为研究鲜有报道.除此之外, 目前开展的吸附实验多在室温下进行, 且实验过程中的铀浓度往往可以达到几十甚至上百mg·L-1, 这些实验条件并不能反映地浸铀矿山退役期间铀迁移环境的真实状态.因此, 本文基于地浸铀矿山的实测数据设置实验条件, 利用我国北方某地浸铀矿山井场外围天然砂岩作为吸附剂研究其对铀的吸附行为, 确定该过程的吸附动力学模型及等温吸附模型, 探讨吸附过程的影响因素, 以期为自然衰减技术在地浸铀矿山地下水修复领域的应用提供科学依据.
2 材料与方法(Materials and methods)2.1 主要试剂与仪器主要试剂:铀标准液(GBW(E) 080173), 浓度为100 mg·L-1, 实验过程中不同浓度的铀溶液均用铀标准液稀释获得;硝酸(UP级, 70%, 北京化学试剂研究所)、氢氧化钠、硝酸钠、硝酸钙、硝酸镁、硫酸钠、碳酸氢钠等为分析纯.
主要仪器:电感耦合等离子体原子发射光谱仪ICP-AES (ICAP 6000, 热电公司)、X射线衍射仪(Bruker AXS, D8-FOCUS)、超纯水仪(Advantage 10, 美国Millpore公司)、恒温振荡器(HNY-200B)、pH计(PHBJ-260)、电子天平(BSA124S).
2.2 砂岩样品处理与测试本次实验用到的砂岩取自我国北方某地浸铀矿山白垩系上统姚家组地层.实验前用去离子水洗净岩心表面泥浆, 烘干后进行破碎、研磨, 筛分出特定粒径, 用超纯水洗去砂岩表面的浮尘, 烘干备用.
利用XRD测试砂岩样品矿物组成, 结果表明(图 1), 实验用砂岩所含矿物主要为石英、钠长石与钾长石, 3种矿物的质量分数分别为39.5%、31.7%和28.8%.
图 1(Fig. 1)
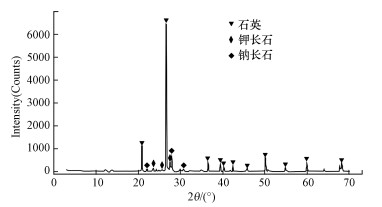 |
| 图 1 砂岩样品的XRD测试图谱 Fig. 1XRD of the sandstone sample |
2.3 实验方法为了确定砂岩粒径大小对实验结果的影响, 在进行动力学实验时, 分别用 < 0.1、0.1~0.15、0.15~0.2、0.2~0.25和0.25~0.5 mm 5个粒径范围颗粒开展实验.将一定量预处理好的不同粒径砂岩样品放入25 mL锥形瓶后加入铀浓度为1 mg·L-1的铀溶液;混合均匀后用体积可以忽略的HNO3和NaOH调整体系的pH至6.5, 将锥形瓶放入恒温摇床, 摇床温度设定为10 ℃(现场实测地下水水温), 转速为240 r·min-1.
在2 min、5 min、10 min、15 min, 30 min、1 h、6 h、12 h、24 h、48 h时, 取反应后溶液, 采用0.45 μm滤膜过滤后, 利用ICP-AES检测溶液中铀浓度.不同粒径条件下, 分配系数Kd随粒径的变化情况见图 2.由图可知, 分配系数Kd值开始时随砂岩粒径的增大而减小, 但粒径增大到0.15~0.2 mm后, Kd值趋于稳定.因此, 在后续研究中选择0.15~0.2 mm作为代表性粒径开展相关实验.
图 2(Fig. 2)
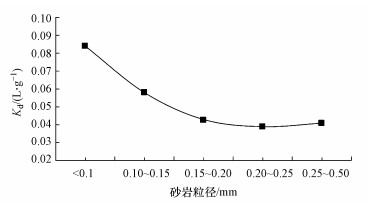 |
| 图 2 砂岩粒径对Kd的影响(T=10 ℃, C0=1 mg·L-1, pH=6.5, 背景电解质:0.85 mg·L-1 NaNO3) Fig. 2Effect of sandstone size on Kd |
在研究某一因素的影响时, 仅改变该因素本身, 其他实验条件与动力学实验条件一致, 分别研究初始铀浓度(0.2~8 mg·L-1, 现场实测地下水中铀浓度范围)、pH(2~8, pH下限值按酸法地浸退役采区内部pH=2计, pH上限值按地下水背景值pH=8计)和其他离子(0.5、1、3、5、10 mmol·L-1的Ca(NO3)2、Mg(NO3)2、Na2SO4、NaHCO3, 现场实测地下水中主要离子种类)对铀吸附的影响.反应12 h后, 采用0.45 μm滤膜过滤, 并利用ICP-AES检测溶液中铀浓度.
根据实验结果计算砂岩对溶液中铀的吸附率η、吸附量Qe和分配系数Kd, 公式如下:
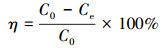 | (1) |
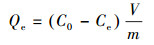 | (2) |
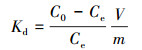 | (3) |
3 结果与讨论(Results and discussion)3.1 砂岩对铀的吸附动力学特征本次实验各取样节点时溶液中的铀浓度变化情况见图 3.由图 3可知, 当反应进行到1 h时, 溶液中的铀浓度由初始的1 mg·L-1降低到0.46 mg·L-1, 吸附率为54%.反应进行到12 h后体系接近动态平衡, 至48 h实验结束时吸附率维持在65%左右.在实验开始阶段, 砂岩样品对铀的吸附较为迅速, 后期吸附速率逐渐下降, 一定时间之后吸附过程趋于平衡.这种吸附现象发生的原因在于实验开始时砂岩具有充足的吸附点位, 可以迅速与溶液中的铀发生吸附反应;随着吸附反应的进行, 砂岩表面的吸附点位不断减少, 造成吸附速率下降;当表面吸附点位被完全占据后, 则吸附过程达到平衡.
图 3(Fig. 3)
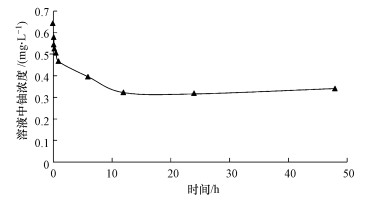 |
| 图 3 溶液中铀浓度随时间的变化情况(T=10 ℃, C0=1 mg·L-1, pH=6.5, 背景电解质:0.85 mg·L-1 NaNO3) Fig. 3Variations of uranium concentration in the solution with time |
利用准一级动力学方程(4)和准二级动力学方程(5)进一步研究砂岩对溶液中铀的吸附动力学过程, 拟合结果见表 1.由表 1可知, 准一级动力学方程拟合的可决系数为0.9527, 准二级动力学方程拟合的可决系数为0.9990, 且准二级动力学方程拟合得到的Qe值更接近实验数据计算值, 表明砂岩对铀的吸附过程更符合准二级动力学方程, 这也表明该过程是化学吸附过程, 其速率控制步骤为化学反应(Nanasivayam et al., 2007).
表 1(Table 1)
| 表 1 吸附动力学方程拟合参数 Table 1 Kinetics parameters of uranium adsorption on the sandstone | ||||||||||||||||||||
表 1 吸附动力学方程拟合参数 Table 1 Kinetics parameters of uranium adsorption on the sandstone
| ||||||||||||||||||||
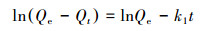 | (4) |
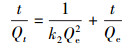 | (5) |
3.2 砂岩对铀的等温吸附特征不同初始铀浓度条件下的吸附量和吸附率变化情况见图 4.由图可知, 随着铀初始浓度的增大, 砂岩对水溶液中铀的吸附量增大, 吸附率减小.这是因为随着铀浓度的增大, 溶液中铀与砂岩表面碰撞的机会增多, 致使单位质量的砂岩对水溶液中铀的吸附量增大;又因为溶液中铀含量增加, 砂岩上的吸附点位会逐渐达到饱和, 致使吸附率减小.
图 4(Fig. 4)
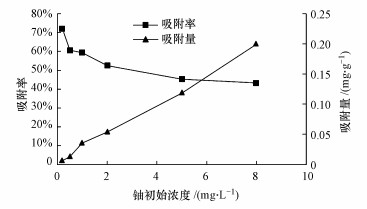 |
| 图 4 初始铀浓度对铀吸附行为的影响(T=10 ℃, pH=6.5, 背景电解质:0.85 mg·L-1 NaNO3) Fig. 4Effect of initial uranium concentration on uranium adsorption on the sandstone |
为了进一步了解砂岩对水溶液中铀的吸附行为, 分别采用Freundlich等温吸附方程(6)和Langmuir方程(7)对实验数据进行拟合, 结果见表 2.由拟合结果可知, Freundlich等温吸附方程更好地反映砂岩对水溶液中铀的吸附情况, 可决系数为0.9810, 这表明砂岩对铀的吸附为多层吸附(Lee et al., 2009).
表 2(Table 2)
| 表 2 砂岩对水溶液中铀的等温吸附参数 Table 2 Isotherm adsorption parameters for uranium adsorbed on sandstones | ||||||||||||||||||||
表 2 砂岩对水溶液中铀的等温吸附参数 Table 2 Isotherm adsorption parameters for uranium adsorbed on sandstones
| ||||||||||||||||||||
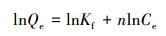 | (6) |
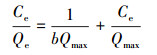 | (7) |
3.3 pH对砂岩吸附铀的影响溶液中铀的吸附率与反应体系pH密切相关, 不同pH条件下的实验结果见图 5.由图 5可知, 在pH=2时, 铀的吸附率最低, 为11.5%;pH在3~6时, 铀的吸附率维持在75%左右, 变化较小;当pH>6时, 铀的吸附率随pH的增大而降低.
图 5(Fig. 5)
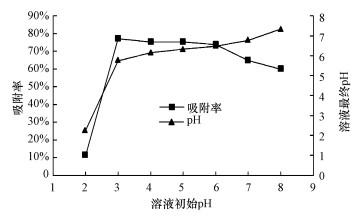 |
| 图 5 pH对铀吸附行为的影响(T=10 ℃, C0=1 mg·L-1, 背景电解质:0.85 mg·L-1 NaNO3) Fig. 5Effects of pH on uranium adsorption on the sandstone |
pH之所以对铀的吸附过程产生影响, 一方面是由于H+的存在会与UO22+发生竞争吸附, 另一方面是由于pH影响着水溶液中铀的物种演化过程(Saleh et al., 2018;Tran et al., 2018).为了进一步解释pH对该吸附过程的影响, 利用地球化学模拟软件PHREEQC模拟了实验条件下铀的物种演化情况与各主要矿物的饱和指数SI.不同pH条件下, 水溶液中铀的物种演化情况见图 6, 各主要矿物饱和指数SI见表 3.
图 6(Fig. 6)
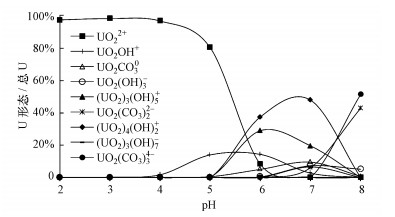 |
| 图 6 不同pH条件下铀物种演化情况(U(VI)浓度为1 mg·L-1, NaNO3浓度为10 mmol·L-1, pCO2=10-3.5 atm, 数据库wateq4f.dat, 不同pH条件下百分比均小于5%的U形态未绘制) Fig. 6Evolution of uranium species under different pH conditions |
表 3(Table 3)
| 表 3 不同pH条件下各主要矿物饱和指数 Table 3 Mineral saturation index under different pH conditions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
表 3 不同pH条件下各主要矿物饱和指数 Table 3 Mineral saturation index under different pH conditions
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
模拟结果显示, pH<5时, 溶液中铀的主要存在形态为UO22+, 随着pH的增大, UO22+会发生水解作用, 与OH-结合, 当pH>6时, 会有一定比例的碳酸铀酰络合物出现, 当pH=8时, 水溶液中铀的主要存在形态则为碳酸铀酰络合物(图 6).
当反应体系的pH=2时, 原生矿物组分钾长石与钠长石均处于对于溶液的非饱和状态(表 3), 会发生明显的溶解作用, 虽然溶液中的H+会有一定的消耗, 但由于反应体系固液比的限制, 钾长石与钠长石全部溶解后仍有较多的H+存在于体系当中, 因此, 整个体系的pH上升不明显;同时, H+会占据砂岩表面上的吸附活性位点, 在占据活性位点后会对带有正电荷的UO22+形成静电排斥作用, 阻止UO22+向活性位点靠近, 因此, 该pH条件下铀的吸附率极低, 仅为11.5%.
当溶液初始pH大于2时, 实验条件下原生矿物钾长石、钠长石与石英均处于对于溶液的平衡状态(表 3), 钾长石与钠长石溶解到一定量后不再发生溶解, 而原生矿物溶解释放的K、Na、Al、Si等元素促使了三水铝石、高岭石和白云母等次生矿物的生成, H+浓度较低且被部分消耗, 减小了其与UO22+的竞争吸附能力.因此, pH大于2时, 铀的吸附率维持在一个较高水平.此外, 由铀的物种演化情况可知, 当溶液pH>3时, UO22+开始发生水解作用, 形成半径更大的UO2OH+、(UO2)3(OH)5+、(UO2)4(OH)7+等络合离子, 阻碍了其在砂岩表面的吸附, 随着pH的增大, 铀的吸附率会略有降低(崔瑞萍等, 2015).当反应体系的pH=8时, 溶液中的铀主要以(UO2)3(CO3)22-、UO2(CO3)34-等迁移性更强的负电荷络合离子形式存在, 吸附率会进一步降低.
3.4 主要离子对铀吸附影响由图 7可知, 砂岩对溶液中铀的吸附率会随反应体系中Ca2+、Mg2+、SO42-、HCO3-等离子浓度的升高而下降, 4种离子都在一定程度上抑制了砂岩对铀的吸附.Ca2+、Mg2+等阳离子, 会与带正电荷的UO22+争夺砂岩上的吸附点位, 且其浓度越高时, 争夺能力越强(Davis et al., 2004;Dangelmayr et al., 2017; 2018), 因此, 随着Ca2+、Mg2+等离子浓度的增大, 铀的吸附率不断减小.对于SO42-、HCO3-等阴离子而言, 其对铀吸附过程的抑制主要体现在阴离子可以与UO22+形成迁移性更强的铀酰络合物(Fox et al., 2006;Alam et al., 2014;Bhargava et al., 2015), 进而造成砂岩对溶液中铀吸附率的降低.当添加的其他离子的离子强度相等时, 各离子对砂岩吸附性能的抑制情况有所差别, 各离子对该吸附过程抑制能力从小到大的顺序为:SO42- < Mg2+ < Ca2+ < HCO3-.
图 7(Fig. 7)
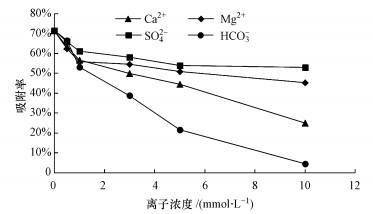 |
| 图 7 离子种类及浓度对铀吸附的影响(T=10 ℃, C0=1 mg·L-1, pH=6.5, 背景电解质:0.85 mg·L-1 NaNO3) Fig. 7Effects of ion concentrations on uranium adsorption on the sandstone |
4 结论(Conclusions)1) 砂岩对溶液中铀的吸附符合准二级动力学方程, 数据拟合可决系数R2为0.9990, 表明该过程是一个由化学反应控速的吸附过程.
2) 随着溶液中铀初始浓度的增大, 砂岩对水溶液中铀的吸附量增大, 吸附率减小.用Langmuir和Freundlich等温吸附模型对吸附实验数据进行拟合, 其可决系数分别为0.7652和0.9810, 表明砂岩对铀的等温吸附过程更符合Freundlich等温吸附模型, 该过程为多分子层吸附过程.
3) 溶液pH对铀的吸附过程有明显影响, 溶液pH=3时, 铀的吸附率达到最高, 为77%.通过实验表明, 在铀矿地浸退役采区地下水所处的pH范围内, 通过砂岩自身的吸附作用这一自然衰减过程, 可以使水溶液中的铀浓度降低70%以上.
4) 砂岩对溶液中铀的吸附率会随反应体系中Ca2+、Mg2+、SO42-、HCO3-等离子浓度的升高而下降, 4种离子对该吸附过程抑制能力从小到大的顺序为:SO42- < Mg2+ < Ca2+ < HCO3-.
参考文献
| Alam M S, Cheng T. 2014. Uranium release from sediment to groundwater:Influence of water chemistry and insights into release mechanisms[J]. Journal of Contaminant Hydrology, 164: 72-87. |
| Bhargava S K, Ram R, Pownceby M, et al. 2015. A review of acid leaching of uraninite[J]. Hydrometallurgy, 151: 10-24. DOI:10.1016/j.hydromet.2014.10.015 |
| 崔瑞萍, 李义连, 景晨. 2015. 伊利石对水溶液中低浓度铀的吸附[J]. 环境化学, 34(2): 314-320. |
| Corlin L, Rock T, Cordova J, et al. 2016. Health effects and environmental justice concerns of exposure to uranium in drinking water[J]. Current Environmental Health Reports, 3(4): 434-442. DOI:10.1007/s40572-016-0114-z |
| 代春艳, 焦学然, 韩文艳, 等. 2014. 地浸采铀工艺技术及发展研究方向[J]. 广东化工, 41(10): 80-80. |
| Dong Y, Xie Y, Li G, et al. 2016. Efficient natural attenuation of acidic contaminants in a confined aquifer[J]. Environmental Earth Sciences, 75(7): 1-8. |
| Dangelmayr M A, Reimus P W, Wasserman N L, et al. 2017. Laboratory column experiments and transport modeling to evaluate retardation of uranium in an aquifer downgradient of a uranium in-situ recovery site[J]. Applied Geochemistry, 80: 1-13. |
| Dangelmayr M A, Reimus P W, Johnson R H, et al. 2018. Uncertainty and variability in laboratory derived sorption parameters of sediments from a uranium in situ recovery site[J]. Journal of Contaminant Hydrology, 213: 28-39. DOI:10.1016/j.jconhyd.2018.04.001 |
| Davis J A, Meece D E, Kohler M, et al. 2004. Approaches to surface complexation modeling of uranium(VI) adsorption on aquifer sediments[J]. Geochim Cosmochim Acta, 68(18): 3621-3641. DOI:10.1016/j.gca.2004.03.003 |
| El-Naby, H H A, Dawood Y H. 2008. Natural attenuation of uranium and formation of autunite at the expense of apatite within an oxidizing environment, south Eastern Desert of Egypt[J]. Applied Geochemistry, 23: 3741-3755. DOI:10.1016/j.apgeochem.2008.09.011 |
| Fox P M, Davis J A, Zachara J M. 2006. The effect of calcium on aqueous uranium(VI) speciation and adsorption to ferrihydrite and quartz[J]. Geochimica Et Cosmochimica Acta, 70(6): 1379-1387. DOI:10.1016/j.gca.2005.11.027 |
| 黄俊文, 冷阳春, 宋怡婷, 等. 2019. 绿泥石对U(VI)的吸附特征研究[J]. 四川大学学报(自然科学版), 56(2): 313-317. |
| Ho Y S, Mckay G. 1999. Pseudo-second order model for sorption processes[J]. Process Biochemistry, 34(5): 451-465. |
| 李仕友, 史冬峰, 唐振平, 等. 2017. 壳聚糖/氧化石墨烯复合材料吸附U(VI)的特性与机理[J]. 环境科学学报, 37(4): 1388-1395. |
| Lagergren S. 1898. About the theory of so-called adsorption of soluble substances[J]. Kungliga Svenska Vetenskapsakademiens Handlingar, 24: 1-39. |
| Lee S J, Chung S G, Kim D, et al. 2009. New method for determination of equilibrium/kinetic sorption parameters[J]. Current Applied Physics, 9(6): 1323-1325. DOI:10.1016/j.cap.2008.12.016 |
| Mudd G M. 2001. Critical review of acid in situ leach uranium mining:1.USA and Australia[J]. Environmental Geology, 41(3/4): 390-403. |
| Nanasivayam C, Sureshkumar M V. 2007. Modelling thiocyanate adsorption onto surfactant-modified coir pith, an agricultural solid waste[J]. Process Safety and Environmental Protection, 85(B6): 521-525. |
| 阙为民, 王海峰, 田时丰, 等. 2005. 我国地浸采铀研究现状与发展[J]. 铀矿冶, 24(3): 113-117. |
| Reinoso-Maset E, Ly J. 2016. Study of uranium(VI) and radium(II) sorption at trace level on kaolinite using a multisite ion exchange model[J]. Journal of Environmental Radioactivity, 157: 136-148. DOI:10.1016/j.jenvrad.2016.03.014 |
| Saleh A S, Lee J Y, Jo Y, et al. 2018. Uranium(VI) sorption complexes on silica in the presence of calcium and carbonate[J]. Journal of Environmental Radioactivity, 182: 63-69. DOI:10.1016/j.jenvrad.2017.11.006 |
| Tran E L, Teutsch N, Klein-BenDavid O, et al. 2018. Uranium and Cesium sorption to bentonite colloids under carbonate-rich environments:Implications for radionuclide transport[J]. Science of the Total Environment, 643: 260-269. |
| 王芳, 张辉, 戴仲然, 等. 2018. 磁性核壳CoFe2O4@SiO2@PIL-AO复合材料的制备及其吸附U(VI)性能研究[J]. 环境科学学报, 38(9): 3605-3613. |
| 徐佳丽.2014.蒙脱石负载纳米零价铁对水溶液中铀的去除研究[D].武汉: 中国地质大学(武汉) |
| 谢水波, 冯敏, 杨金辉, 等. 2014. 腐殖酸改性针铁矿对铀U(Ⅵ)的吸附性能及机理研究[J]. 环境科学学报, 34(9): 2271-2278. |
| Zammit C M, Brugger J, Southam G, et al. 2014. In situ recovery of uranium-the microbial influence[J]. Hydrometallurgy, 150: 236-244. |
| Zhu C, Hu F Q, Burden D S. 2001. Multi-component reactive transport modeling of natural attenuation of an acid groundwater plume at a uranium mill tailings site[J]. Journal of Contaminant Hydrology, 52: 85-108. |
