
论文发表截图
肠道微生物作为连接人体内外环境的桥梁,已被证实在多种人类代谢性疾病中发挥了关键的角色。尽管当前的肠道微生物研究主要关注其产生的小分子代谢物对机体的影响,但对其他功能分子如蛋白质的研究相对缺乏。肠道共生菌的多种酶在代谢物的生成和代谢过程中具有重要的作用。此外,这些菌源酶不仅具有多种与代谢物无关的功能,其在代谢性疾病中的作用仍然尚不清晰。
乔杰院士与合作者团队首次提出了肠道菌源宿主同工酶(Microbial-host-isozyme,MHI)这一新的科学概念,并发现这种菌源宿主同工酶在肠道中广泛存在,能够有效模拟宿主酶的功能,并在疾病的发生和发展中发挥关键作用。
研究人员发现菌源二肽基肽酶4(DPP4)可以通过分泌进入宿主体内并分解活性胰高血糖素样肽-1(GLP-1),进而诱导糖耐量异常。同时,他们发现宿主DPP4抑制剂西格列汀无法有效抑制菌源DPP4的活性。如果患者体内菌源DPP4富集,将会降低西格列汀的临床治疗效果。这一发现揭示了西格列汀临床响应性的个体差异的机制,并找到了关键的作用靶点。
研究人员进一步通过高通量筛选十万种化合物,发现Daurisoline-d4(Dau-d4)能通过特异性抑制菌源DPP4,增加活性GLP-1水平,从而降低血糖。这为后续的基础研究和临床治疗提供了新的研究思路和方向。
这一研究构建了从靶点发现到机制验证,再到药物筛选和疗效验证的全链条研究体系,为理解代谢性疾病的发生机制,提高代谢性疾病药物治疗效果,甚至发现新的治疗方法提供了可能。
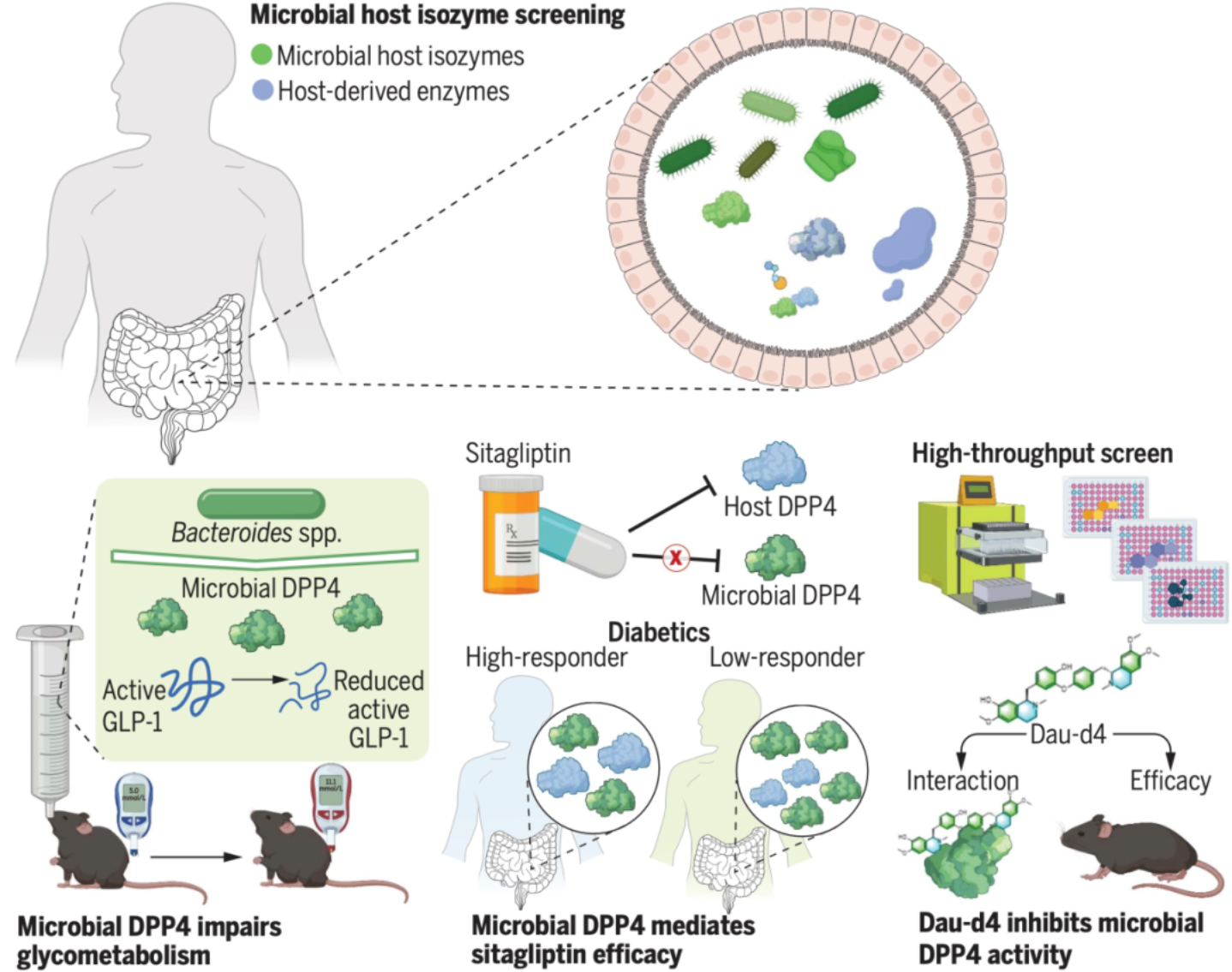
肠道菌源宿主同工酶跨物种调控宿主代谢性疾病
北京大学医学部博士后汪锴、北京大学医学部基础医学院博士生张志威、北京大学第三医院副研究员杭婧、首都医科大学附属朝阳医院教授刘佳、北京大学化学与分子工程学院博士生郭富生为共同第一作者;姜长涛、乔杰、雷晓光、美国国立卫生研究院研究员Frank Gonzalez、首都医科大学附属朝阳医院教授王广为共同通讯作者。
本研究得到女性生育力促进全国重点实验室、血管稳态与重构全国重点实验室的大力支持,并得到了国家自然科学基金基础科学中心、重点项目、****科学基金以及国家重点研发计划基金等资助。
共同第一作者

杭婧
北医三院生殖医学科
副研究员、助理教授、博士生导师
北京市科技新星
主要研究方向:生殖和妊娠障碍的结构机制与代谢调控研究
共同通讯作者

乔杰
中国工程院院士
北京大学常务副校长
北京大学医学部主任
北医三院医学创新研究院院长
北医三院生殖医学科
主任医师、教授、博士生导师
主要研究方向:女性生育力促进
