真核细胞中高度区室化的亚细胞结构为不同的细胞生理过程提供了特定的化学环境,而蛋白质作为执行生命活动的主要分子,其执行的生理功能与其所处的亚细胞定位密切相关。因此研究细胞内蛋白质分子在各区域的精细分布对于理解细胞生命活动具有重要意义。传统研究手段包括基于免疫荧光的成像技术、基于免疫沉淀的生化分离技术等,然而这些手段存在着分析通量较低、时空分辨率差、缺乏亚细胞区域普适性等缺点。
针对这些难题,邹鹏课题组开发了由可见光引发的光催化蛋白质标记与鉴定技术RinID。该方法利用可见光激发遗传靶向的蛋白质光催化剂miniSOG,由此产生的单线态氧可以对邻近蛋白质分子上的组氨酸进行氧化。于此同时,氧化产物被外源加入的小分子氨基探针原位捕获,将一个生物正交官能团共价交联到蛋白质上,进而通过亲和富集得以纯化,利用液相色谱串联质谱进行蛋白质组检测。标记的空间特异性由两方面保证,一是miniSOG能够通过遗传靶向(融合特定蛋白质或定位肽)精准定位于特定的亚细胞区域,二是单线态氧具有微秒尺度的寿命从而将标记半径局限在几十纳米的空间范围内。
邹鹏课题组利用RinID技术系统研究了多个亚细胞区域的蛋白质组,包括线粒体、内质网、细胞核等,均获得了出色的空间特异性(>90%),高于目前常用的APEX2、TurboID等技术。进一步地,他们利用了光控标记的标记窗口可控与毒性较低的特征,将脉冲-追踪式标记与RinID结合,发展了Pulse-chaseRinID方法,在HeLa细胞的内质网腔中鉴定了97种蛋白质在0—24小时内在细胞中的清除速率。由此发现,分泌蛋白相比于内质网驻留蛋白具有更高的清除速率。
RinID具有操作简单、空间选择性高、时间窗口高度可控、生物相容性好的特点,将成为一项适合于在多种生物系统中研究亚细胞转录组的新技术。另外值得强调的一个优势是,邹鹏课题组在2019年与2020年相继报道了由miniSOG介导的光催化标记活细胞局部的RNA(https://www.nature.com/articles/s41589-019-0368-5)与DNA(https://onlinelibrary.wiley.com/doi/10.1002/anie.202005486)技术CAP-seq。新报道的蛋白质组标记RinID技术进一步拓展了可见光催化的时空分辨标记工具箱,可以实现用同一个光催化标签蛋白、同一个细胞系来同时实现蛋白质组、转录组、基因组的标记,为开展多维组学研究提供了重要工具。
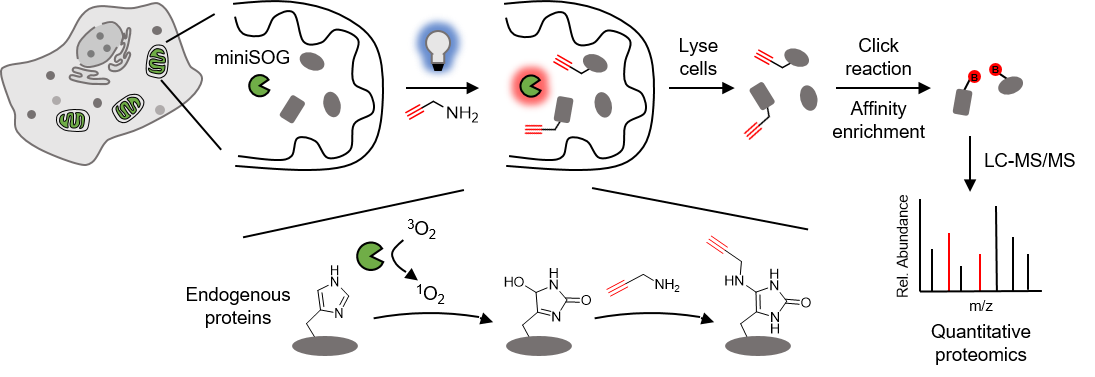
RinID技术流程示意图
北京大学化学与分子工程学院博士生郑甫为该论文第一作者,邹鹏为论文通讯作者。该工作得到了北大-清华生命科学联合中心、科技部、国家自然科学基金委的资助。
