2023年3月30日,北京大学生命科学学院李毓龙教授团队联合北京脑科学与类脑研究所罗敏敏教授团队在PNAS杂志在线发表了题为“Neuronal activity-induced, equilibrative nucleoside transporter-dependent, somatodendritic adenosine release revealed by a GRAB sensor”的研究论文。在这项研究中,作者利用新型GRAB荧光探针,详细地研究了神经元活动引发腺苷释放的细胞及分子机制,并揭示了一种非经典的神经调质释放模式。

论文截图
胞外腺苷来源的争议可以归结为以下几个方面:(1)在细胞水平上,腺苷是来源于神经元还是相邻的胶质细胞?(2)腺苷释放是否具有亚细胞结构的特异性,从突触前还是突触后释放?(3)在分子水平上,腺苷是通过胞外的三磷酸腺苷(ATP)的降解产生;还是通过核苷转运蛋白或突触囊泡直接被释放?
研究胞外腺苷的来源、释放及调控机制的难点在于缺乏可视化检测腺苷的方法。2020年,李毓龙团队和徐敏团队联合报道了一种基于G蛋白偶联受体激活原理(GRAB)的胞外腺苷荧光探针GRAB-Ado1.04,Ado1.0对胞外腺苷的亲和力是~60nM。在本次报道的研究中,为了进一步扩展探针的检测范围,作者通过筛选得到了一个~3.2μM的低亲和力版本Ado1.0m,该探针表现出更大的响应幅度(大于300%)和对腺苷的高特异性。
利用新版Ado1.0m探针,作者成功地在海马急性脑片CA1位置检测到电刺激引发的胞外腺苷水平的上升。有趣的是,作者发现阻断CA3到CA1的谷氨酸突触传递只能部分阻断胞外腺苷水平的上升。那么胞外的腺苷是来源于CA1局部的胞体树突(突触后)还是CA3的轴突投射(突触前)?结合光遗传学工具和胞外腺苷成像,作者发现在阻断谷氨酸突触传递的基础上同时激活CA3轴突,并不能引发腺苷释放;而当激活CA1胞体树突时则发现,胞外腺苷水平表现出刺激时长依赖的增加(图1)。以上结果表明,在亚细胞水平上,胞外腺苷主要来源于CA1的胞体树突(突触后)。
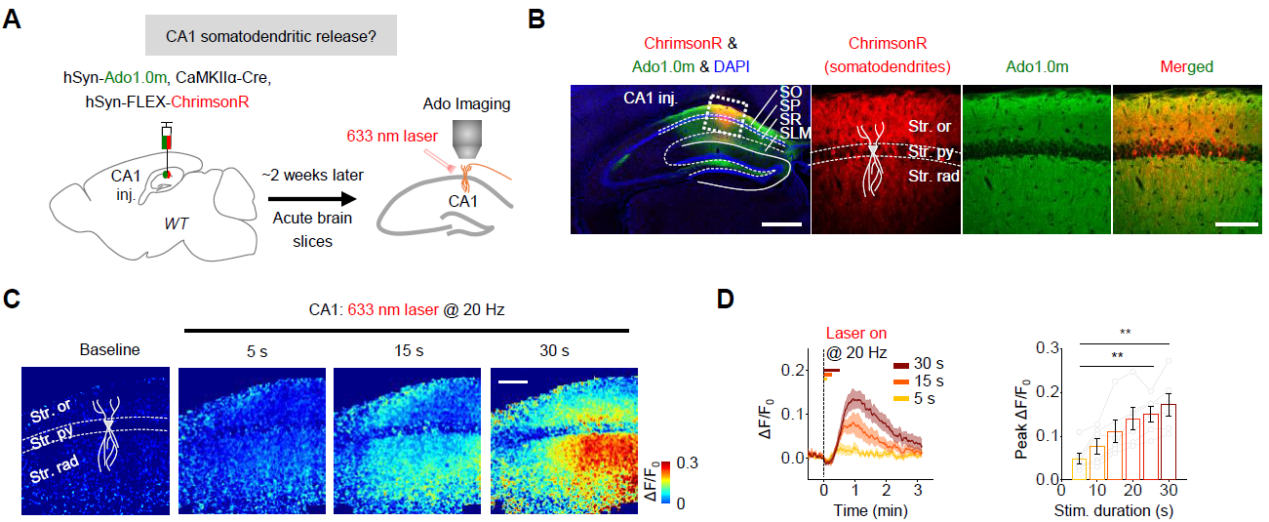
图1:激活CA1胞体树突引发胞外腺苷水平的上升
作者使用培养的海马神经元体系研究胞外腺苷来源的分子机制。结合GRAB腺苷探针、谷氨酸探针及药理学、遗传学等手段,作者发现:在细胞水平上,通过电场刺激能够引发腺苷的释放,而当通过河豚毒素、氯化镉分别阻断表达在神经元上的电压敏感的钠离子和钙离子通道时,腺苷的释放也被阻断,表明胞外的腺苷来源于神经元;当激活星形胶质细胞时,则没有检测到胞外腺苷水平的上升。作者还发现胞外腺苷水平的上升主要依赖于的L-型钙离子通道,胞内钙库的激活也能引发腺苷的释放。
分子水平上,破伤风神经毒素能够有效地阻断突触囊泡释放的谷氨酸,却无法阻断腺苷的释放,表明腺苷的释放不依赖于SNARE蛋白介导的胞吐过程;阻断CD39或者敲除CD73(胞外ATP降解成腺苷的限速酶)对胞外腺苷的释放没有明显的影响,表明CD39-CD73介导的胞外ATP降解途径对电刺激引发的腺苷释放贡献不大;有意思的是,通过药理学手段阻断或者遗传学手段敲除细胞膜表达的平衡核苷转运蛋白(ENTs),大部分腺苷的释放被阻断,表明在神经元被激活时,胞外腺苷水平的上升主要依赖于ENT转运蛋白(图2)。
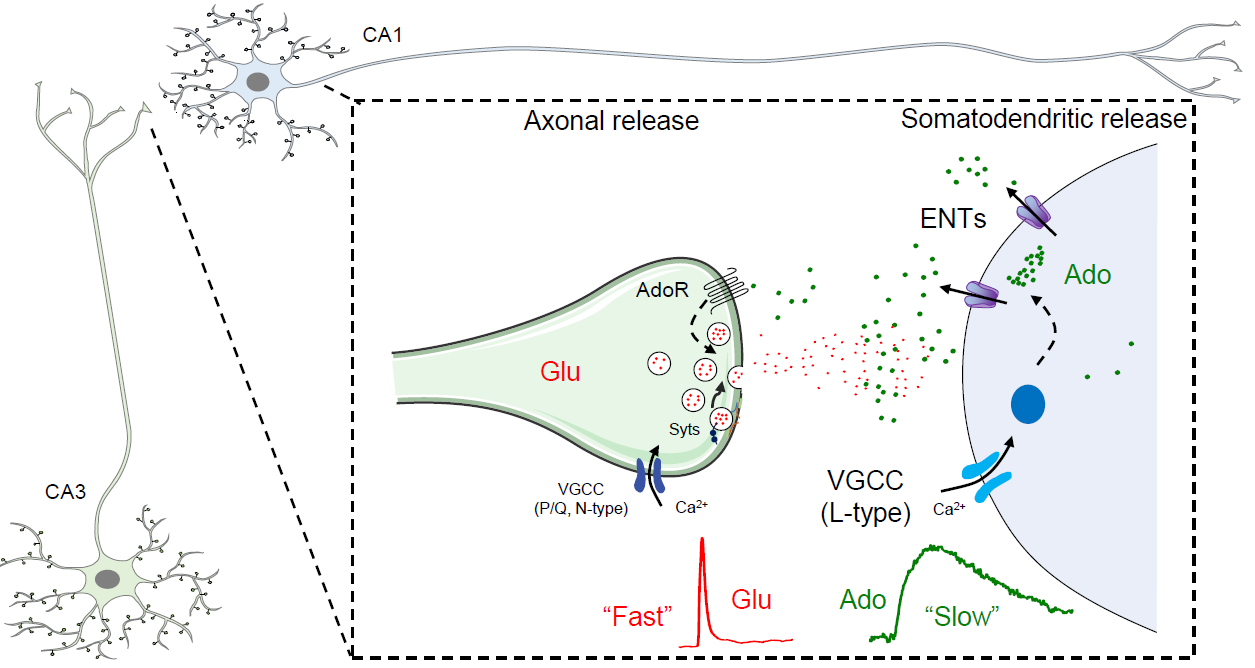
图2:神经元活动引发腺苷释放的模式图
综上,作者发现在海马中神经元活动诱导的胞外腺苷升高主要是由神经元释放的,并取决于ENTs,而不是通过传统的囊泡释放机制;与经典神经递质相比,胞外腺苷积累缓慢(约40秒)并且需要L-型钙离子通道。重要的是,作者发现腺苷主要由突触后直接释放,而不是突触前;基于在突触前膜有丰富的腺苷受体表达,表明突触后释放的腺苷是一个潜在的逆行调控分子(图2)。由于腺苷信号传递及其代谢参与多种生理(睡眠-觉醒调控等)及病理过程(癫痫、中风、疼痛、帕金森病,乃至肿瘤发生等),这项基础研究为理解腺苷的作用机理提供了重要参考,也为腺苷相关疾病的治疗提供了潜在的药物靶点。
武照伐博士、崔玉婷博士和王欢博士为本文的共同第一作者,李毓龙和罗敏敏为共同通讯作者,吴昊、万逸博士、李柏翰、王蕾、潘孙磊、彭婉玲博士、董傲博士、袁正巍博士和井淼博士等对前期探针的开发和刻画作出了重要贡献。论文的合作者还包括中国科学院脑科学与智能技术卓越创新中心的徐敏研究员,并得到了北京大学膜生物学国家重点实验室、北大-清华生命科学联合中心、北京大学IDG麦戈文脑科学研究所、国家自然科学基金、北京市科委、生命医学峰基金、新基石研究员项目、科技创新2030-“脑科学与类脑研究”青年科学家项目、勃林格殷格翰博士后基金和北京市科协“青年人才托举工程”等机构、经费和项目的大力支持。
更多李毓龙实验室工作详见:http://yulonglilab.org/;罗敏敏实验室工作详见:https://www.cibr.ac.cn/science/team/detail/36。
参考文献:
1.Chen, J. F., Eltzschig, H. K. & Fredholm, B. B. Adenosine receptors as drug targets--what are the challenges? Nat Rev Drug Discov12, 265-286, doi:10.1038/nrd3955 (2013).
2.Drury, A. N. & Szent-Gyorgyi, A. The physiological activity of adenine compounds with especial reference to their action upon the mammalian heart. J Physiol68, 213-237, doi:10.1113/jphysiol.1929.sp002608 (1929).
3.Phillis, J. W., Kostopoulos, G. K. & Limacher, J. J. Depression of Corticospinal Cells by Various Purines and Pyrimidines. Canadian Journal of Physiology and Pharmacology52, 1226-1229, doi:10.1139/y74-162 (1974).
4.Peng, W. et al. Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons. Science369, doi:10.1126/science.abb0556 (2020).
