最近,基因编辑领域工作者陆续开发出包括Cas12e(<1000 aa)以及Cas12f家族(400-700 aa)在内的数种微型基因编辑工具。它们可有效克服困扰已久的腺相关病毒(adeno-associated virus,AAV)递送的载荷大小问题。相比于传统的Cas9或Cas12a,目前领域内缺乏对于这些微型基因编辑工具的编辑活性以及安全性的系统性评估,这使得临床上编辑工具的选择仍缺乏科学有效的指导。

文章截图
2022年9月24日,胡家志课题组在Nature Communications在线发表题为“Comprehensive assessment of miniature CRISPR-Cas12f nucleases for gene disruption”的研究论文。该研究应用PEM-seq技术对领域内多种CRISPR-Cas系统的编辑活性、脱靶效应以及对基因组稳定性的影响进行了横向比较,重点描绘了CRISPR-Cas12家族编辑工具的特征。
在编辑活性方面,作者利用GFP荧光报告系统以及PEM-seq技术,对领域内四种新型的Cas12f核酸酶(Un1Cas12f1_ge4.1、CasMINI、CasMINI_ge4.1、AsCas12f1)、两种Cas12e核酸酶(PlmCas12e及其优化版本PlmCas12e-R1-v2)以及SpCas9、AsCas12a、LbCas12a的编辑活性进行了详细比较。作者发现,新型的Un1Cas12f1、两种CasMINI及PlmCas12e-R1-v2编辑工具在HEK293T细胞中展现了相对有效的编辑活性,尽管其效率普遍低于Cas9或Cas12a;而AsCas12f1及PlmCas12e在大多数位点的编辑效果不佳(图一A-B)。这与之前研究人员猜测AsCas12f1嗜热酶的特性使得其在人类细胞中很难实现最佳的切割活性相吻合3。研究人员进而分析了在有效编辑活性下,这些不同CRISPR-Cas系统产生的小规模插删(small insertions and deletions,indels)产物的序列特征。作者发现,与Cas9相比,Cas12核酸酶编辑基因组后更倾向于产生缺失产物,并且其碱基缺失的长度与Cas12核酸酶不对称切割两条DNA链所产生黏性末端的突出(overhang)长度相关(图一C),暗示了Cas12编辑更适用于某些需要对特定DNA片段进行删除从而实现治疗效果的临床疾病。相应地,Cas12大大降低了碱基插入的比例,包括在SpCas9编辑产物中频繁出现的1-bp插入。这些结果暗示了不同断裂末端对基因编辑产物的影响。
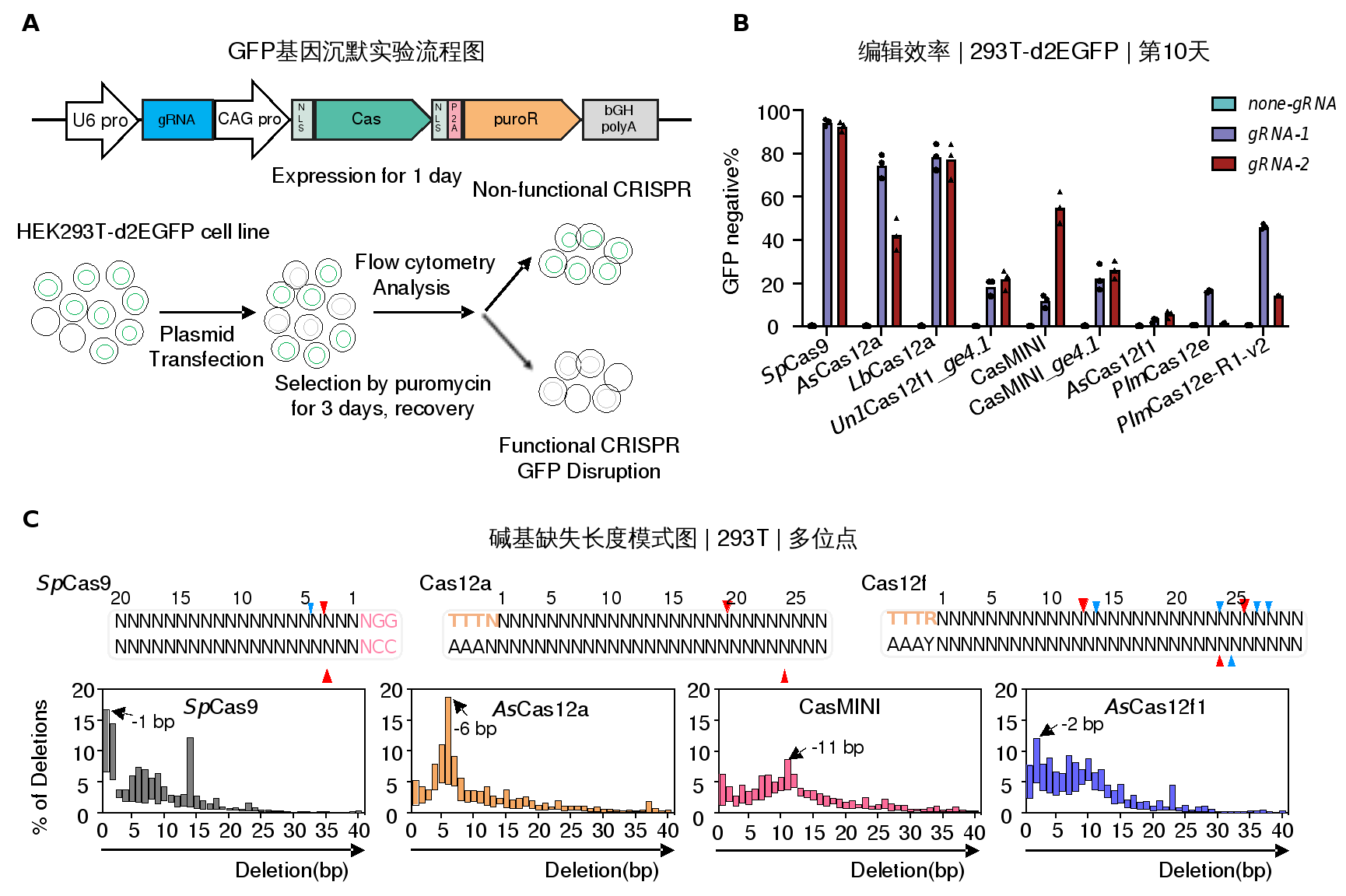
图一. 通过EGFP沉默实验和PEM-seq技术评估微型Cas12核酸酶的编辑能力。A. 不同CRISPR-Cas系统在HEK293T-d2EGFP细胞系的编辑效率检测流程图;B. 在指定靶位点不同Cas酶的GFP基因破坏效率;C. 不同CRISPR-Cas系统编辑产生的碱基缺失长度的模式图
在脱靶活性方面,进一步研究发现,Cas12f核酸酶具有相对更高的编辑特异性,尽管这种高特异性可能是由于其与Cas9和Cas12a核酸酶相比而言整体较低的编辑活性。在研究者检测的大多数位点上,都几乎检测不到Cas12f的脱靶位点,而与之共享靶向序列的SpCas9却能够检测到大量的脱靶位点,说明Cas12f具有较低的脱靶活性(图二A)。这可能是由于Cas12f对于PAM的识别特异性较高,或者其相对较低的编辑活性所导致。
在染色体结构变异方面,该研究利用PEM-seq分析方法,详细比较了各种CRISPR-Cas系统所产生的基因编辑副产物。作者发现,染色体易位、染色体大片端缺失这些有害的基因编辑副产物普遍存在于各个CRISPR基因编辑系统中,但Cas12f核酸酶可以相对有效地抑制这些副产物的产生,这可能与Cas12f编辑酶切割基因组后产生的黏性末端影响了DNA修复途径相关。具体而言,在该研究所检测位点上,SpCas9平均产生了占编辑事件3.6%的染色体易位,1.9%的染色体大片段缺失副产物;而四种Cas12f产生的染色体易位比例处于1.2%-1.6%之间,产生的染色体大片段缺失比例处于0.5%-1.2%之间(图二B-C)。虽然这些染色体结构异常的发生频率相对较低,但常常与癌症的发生相偶联,是基因编辑过程中值得注意的副产物。
在外源DNA片段插入方面,值得警惕的是,作者在靶向位点也发现了大片段的DNA插入事件,通过与递送质粒序列进行比对,发现这些片段来源于递送载体,外源DNA片段的插入会影响插入位点附近其他基因的表达情况,甚至引发细胞癌变,这为基因编辑带来了不确定性。SpCas9平均产生了占编辑事件5.2%的外源DNA片段插入副产物,而Cas12f切割所导致的外源DNA片段插入事件的比例可降至1.1-2.2%之间(图二D)。

图二. PEM-seq全面评估各种CRISPR-Cas编辑系统的基因编辑副产物。A.不同编辑工具在FGF18位点所产生的脱靶位点的数目与分布;B-D. 不同Cas酶在基因编辑中所产生的染色体易位事件(B),染色体大片段缺失(C),外源DNA片段插入(D)的比例
总体而言,该工作利用PEM-seq技术系统地比较了各个CRISPR-Cas编辑系统编辑过程中的DNA修复产物,揭示了不同断裂末端影响各类编辑产物的潜在机制,也为新型Cas12f基因编辑工具的临床应用做出了前瞻性的指导。该工作也证实,PEM-seq技术方法用于描绘基因编辑工具特征的广谱适用性、全面性与高灵敏性。但Cas12f目前仍存在着总体编辑活性较低的问题,在保持其安全性的同时,进一步提高其编辑效率将极大地推动微型基因编辑工具的广泛应用。胡家志课题组之前将核酸外切酶与Cas9相偶联生成Cas9TX的思路3为这些新型编辑工具的优化提供了方向。
胡家志为该文章的通讯作者。胡家志课题组2018级博士研究生辛昌昌和2022届博士毕业生尹健行为该文章的共同第一作者。北京大学生命科学学院2021级本科生元绍鹏、北京大学前沿交叉学院2021级博士研究生欧丽琼等为该工作提供了重要帮助。该工作得到中国农业农村部、科技部国家重点研发计划、国家自然科学基金、细胞增殖与分化教育部重点实验室、北大-清华生命科学联合中心、北京大学临床医学+X专项以及生命科学学院仪器中心(成像平台及流式平台)的资助。胡家志实验室长期招收对生物信息学和免疫基因组学感兴趣的学生和博士后。
参考文献:
1. Yin J. et al. The origin of unwanted editing byproducts in gene editing. Acta Biochim Biophys Sin (Shanghai). 2022 May 25;54(6):1-15. doi:10.3724/abbs.2022056. PMID: 35643959.
2.Yin, J. et al. Optimizing genome editing strategy by primer-extension-mediated sequencing. Cell Discov 5, 18, doi:10.1038/s41421-019-0088-8 (2019).
3.Wu, Z. et al. Programmed genome editing by a miniature CRISPR-Cas12f nuclease. Nat Chem Biol 17, 1132-1138, doi:10.1038/s41589-021-00868-6 (2021)
4. Yin J. et al. Cas9 exo-endonuclease eliminates chromosomal translocations during genome editing. Nat Commun. 2022 Mar 8;13(1):1204. doi: 10.1038/s41467-022-28900-w. PMID: 35260581.
