近年来高通量测序技术已经被广泛应用于研究结直肠癌的发病机制和分子机理。然而,在单细胞水平同时对多个组学的数据进行整合分析、探究不同组学层面之间的调控关系、并构建结直肠癌的亚克隆组成和转移模型的研究目前仍然比较缺乏。
2022年8月16日,北京大学生物医学前沿创新中心(BIOPIC)汤富酬课题组与北京大学第三医院普通外科付卫课题组合作在Genome Medicine杂志上发表了题目为“Single-cell Genomic and Transcriptomic Landscapes of Primary and Metastatic Colorectal CancerTumors”的研究论文。
该研究对11位转移性结直肠癌患者的手术切除样品,采用多点取样的策略,获取了原发位肿瘤组织、淋巴结转移位肿瘤组织、肝脏转移位肿瘤组织、网膜转移位肿瘤组织,癌旁正常粘膜以及患者外周血样品,对9000多个单细胞进行了高精度单细胞转录组测序分析。对于其中8位患者同时获得了正常癌旁组织、原发位肿瘤组织和转移位肿瘤组织的多点取样配对样品的高精度单细胞转录组测序数据。此外,该研究对其中9位患者的84个样品进行了全基因组浅测序,对81个样品进行了全外显子组深测序。
该研究不仅系统地分析了结直肠癌在发展和转移过程中不同细胞类型和肿瘤亚克隆组成、基因表达、信号通路、基因组拷贝数变异和体细胞突变的动态变化,还在单细胞水平上研究了重要结直肠癌驱动基因与基因表达、肿瘤亚克隆以及肿瘤转移之间的关系。

图1结直肠癌肿瘤样本的取样流程图
该研究有以下几个主要发现:
1、发现SOX9+MKI67+双阳性癌细胞表现出肿瘤干细胞样生物学特征。该研究系统地比较了肿瘤组织和癌旁组织的细胞组成,发现肿瘤组织中T淋巴细胞和成纤维细胞的比例显著增加,并且肿瘤上皮细胞(癌细胞)的干性相关特征增强,高表达潘式细胞(Paneth cell, LYZ)和肠上皮干细胞(SOX9和MKI67)的部分特征基因。而癌旁正常粘膜主要由分化成熟的上皮细胞组成,如肠上皮(Enterocyte)和杯状细胞(Goblet cell)。该研究通过构建肿瘤类器官,比较短期培养和长期培养后肿瘤类器官中分化细胞和干细胞样细胞的比例,发现相对于体内的肿瘤细胞,体外培养的类器官中SOX9+MKI67+双阳性细胞比例显著增高(体内肿瘤细胞:24%-26%,体外肿瘤类器官:74%)。而肿瘤类器官经过长期培养以后,高表达分化细胞特征基因CA2的细胞比例显著增加,说明SOX9+MKI67+双阳性细胞具有自我更新和分化的潜能,是肿瘤干细胞样细胞(stem cell-like cells)。

图2A.柱状图展示了第一号患者的体内不同肿瘤区域以及体外原发位肿瘤细胞诱导形成的肿瘤类器官中SOX9/MKI67双阳性细胞的比例。B. 柱状图展示了H患者体外短期培养和长期培养的肿瘤类器官表达分化细胞特征基因CA2的比例。C.第H号患者体外短期培养和长期培养的类器官SOX9、MKI67、CA2免疫荧光染色图。CO:肿瘤类器官;2W:2周;1/2M:1/2个月
为了进一步验证SOX9+MKI67+双阳性细胞的分化潜能,该研究对一个患者的五个类器官小球进行了高精度单细胞转录组测序分析。单个类器官小球一般是由少量(三、四个细胞)甚至是单个细胞通过多次细胞分裂形成的三维细胞团。结合单细胞线粒体突变分析,可判断单个类器官小球中不同细胞的克隆关系,并对单个类器官小球中的不同细胞克隆中的细胞表型变化进行追踪,进而推测肿瘤细胞的分化路径。结果显示单个类器官小球内具有相同线粒体突变的细胞克隆中同时存在干细胞样细胞和分化成熟的细胞,并且随着干细胞特征基因SOX9表达的降低,分化细胞特征基因CA2的表达量逐渐升高,这进一步验证了SOX9+MKI67+双阳性细胞是肿瘤干细胞样细胞,具有进一步分化成熟的潜能。
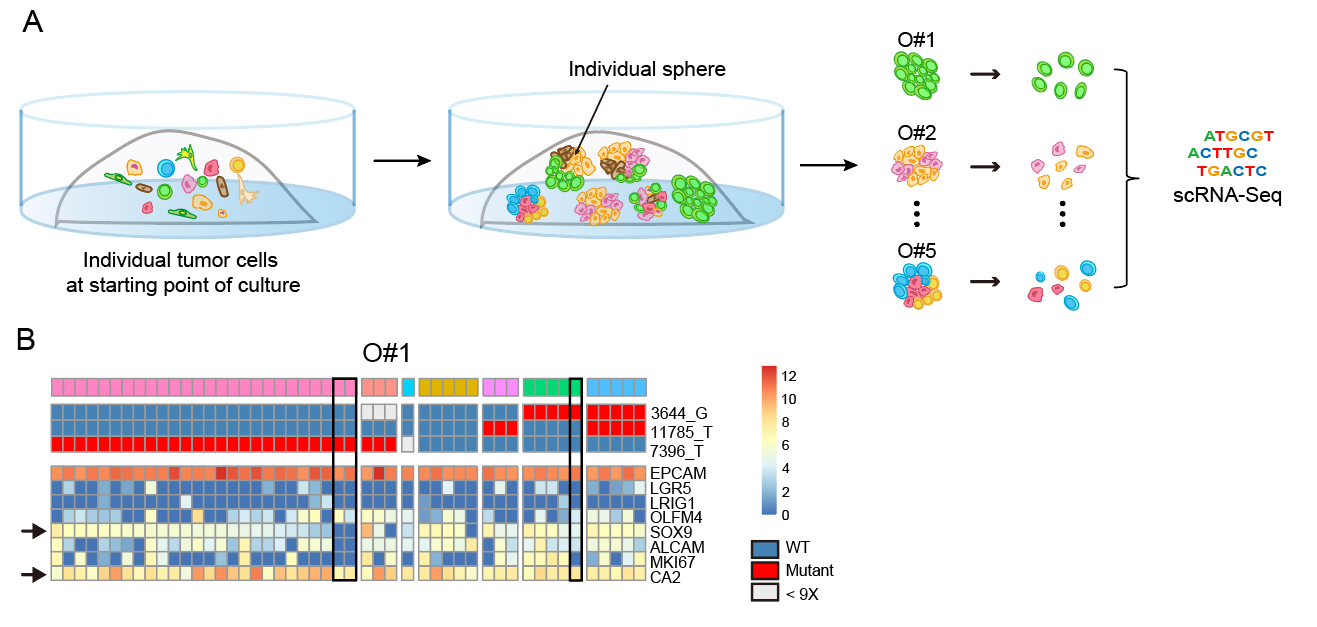
图3A.肿瘤类器官培养以及单个类器官小球的单细胞RNA-Seq实验流程图。B.#1肿瘤类器官小球的线粒体突变,亚克隆组成(上)以及细胞类型特异性基因的表达特征(下)
2、发现结直肠癌肿瘤细胞普遍具有异常激活PPAR信号通路的特征。该研究通过比较正常肠上皮细胞和肿瘤上皮细胞(癌细胞)的基因表达特征,发现肿瘤细胞中PPAR信号通路普遍发生异常激活。为了进一步探究PPAR信号通路对肿瘤生长的作用及其潜在的分子机制,该研究构建了结直肠癌类器官体外培养体系。当肿瘤类器官的PPAR信号通路被小分子抑制剂抑制时,肿瘤细胞的增殖速度明显变慢,而细胞凋亡显著增加,PPAR信号通路抑制剂的肿瘤杀伤能力与临床上常用的抗癌药物5FU相当。值得注意的是,当PPAR信号通路和WNT信号通路同时被抑制时,肿瘤细胞会被进一步杀伤。因此该团队进一步探究了PPAR信号通路和WNT信号通路抑制剂联合用药的可能性,实验结果显示,PPAR信号通路和WNT信号通路抑制剂的联合用药具有剂量依赖性的特征,当使用低剂量的PPAR信号通路抑制剂处理时,同时加入WNT信号通路抑制剂可提高对肿瘤的杀伤效果。这也表明,结直肠癌的肿瘤类器官培养体系,不仅可用于探究靶向药物的肿瘤治疗效果,还可用于探索不同靶向药物联合使用的可能性,以期降低药物的毒副作用,提高患者的生存率,这对于结直肠癌的临床治疗具有重要的指导意义。

图4A.柱状图展示了不同药物处理后肿瘤类器官的细胞凋亡比例。B.散点图展示了不同药物处理的肿瘤类器官的细胞增殖比例。C.折线图展示了不同浓度的PPAR信号通路抑制剂(GW9662)与WNT信号通路抑制剂(XAV939)处理后,肿瘤类器官的细胞活性
3、发现同一个结直肠癌患者体内不同转移位的肿瘤细胞常常具有独立起源特征。该研究利用高精度单细胞转录组数据在单细胞水平分析了每个肿瘤细胞的染色体拷贝数变异(CNV)以及线粒体点突变,并通过整合分析构建了9位结直肠癌患者的肿瘤亚克隆组成以及肿瘤转移模式。该研究发现结直肠癌患者的肿瘤细胞具有高频的线粒体突变,并且线粒体突变与染色体拷贝数变异以及肿瘤细胞基因表达模式有强相关性。因此,这些肿瘤特异性的线粒体突变可用于准确判断和区分正常上皮细胞、基因组拷贝数变异特征不明显的肿瘤细胞、以及基因组拷贝数变异特征明显的肿瘤细胞。另外,该研究在单细胞水平利用基因组拷贝数变异以及线粒体点突变验证了同一个结直肠癌患者体内的淋巴结转移位肿瘤细胞与肝脏转移位肿瘤细胞独立起源的可能性(也就是说,原发位肿瘤中不同的肿瘤亚克隆分别独立转移到了淋巴结和肝脏,而不是过去通常推测的、原发位肿瘤中的肿瘤亚克隆先转移到淋巴结,之后再由淋巴结转移到肝脏),并揭示了不同远端转移位(例如:肝脏转移位和网膜转移位)肿瘤细胞也具有独立起源的可能性。

图5A.第九号患者的肿瘤细胞基因组拷贝数变异和取样示意图。B.线粒体突变和肿瘤转移模式图

图6 第九号患者基于全外显子组测序数据构建的肿瘤进化树
4、发现EKC/KEOPS复合物可能促进具有TP53突变的结直肠癌肿瘤细胞发生转移。通过对单个细胞同时进行单细胞转录组测序和特定驱动基因突变的cDNA Sanger测序,该研究对结直肠癌患者的肿瘤组织在单细胞水平分析了驱动基因突变与基因表达特征的关系。TP53突变是结直肠癌患者的最常见基因突变之一,该研究对两位有TP53基因突变的患者进行了肿瘤亚克隆分析和肿瘤转移模式重构,发现EKC/KEOPS复合物中的TP53RK、TPRKB基因的高表达可能促进具有TP53突变的肿瘤细胞发生转移。此前的研究通过肿瘤细胞系体外实验表明,TPRKB表达的缺失会造成TP53突变细胞的生长受到抑制,而TP53野生型的肿瘤细胞几乎不受TPRKB表达缺失的影响,表明TPRKB对TP53突变细胞的重要调控作用。该研究首次在患者体内的具有相同遗传背景的肿瘤亚克隆之间验证了EKC/KEOPS复合物对肿瘤转移的潜在作用,有效地排除了体外培养细胞系以及不同患者个体之间比较时由于遗传背景差异可能造成的实验误差。

图7 单细胞cDNASanger测序和单细胞RNA-seq联合测序的实验流程图

图8A.第四号患者的tSNE聚类图。细胞的颜色代表取样位置、线粒体突变、CNV变异亚克隆类型以及OLFM4+SOX9+双阳性细胞相对于OLFM4+单阳性细胞特异性高表达基因的平均表达量。B. 热图展示了OLFM4+SOX9+双阳性细胞和OLFM4+单阳性细胞差异表达基因在第四号患者的不同细胞类型中的表达情况。C.tSNE聚类图展示了TPRKB, TP53RK和IDH1基因在第四号患者上皮细胞中的表达情况
综上所述,该研究通过对晚期转移性结直肠癌患者的单细胞多组学研究,探究了结直肠癌发生发展过程中的肿瘤细胞类型转变和关键信号通路的变化规律,相关结论通过体外类器官培养体系进行了系统的功能验证。同时,体外类器官培养体系为结直肠癌的治疗提供了潜在的联合用药的药效检验策略。另外,该研究深入研究了同一个患者体内原发位肿瘤和不同转移位肿瘤的亚克隆组成,并在此基础上重构了肿瘤转移关系,并在单细胞水平探究了驱动基因突变与基因表达的关系以及驱动基因突变对肿瘤转移的重要作用。
北京大学生物医学前沿创新中心(BIOPIC)的汪睿博士、李静云博士、毛雨诺博士、北京大学第三医院的周鑫副研究员、王文东博士以及中国农业大学高帅研究员为该论文的并列第一作者,北京大学生物医学前沿创新中心汤富酬教授和北京大学第三医院付卫教授为该论文的共同通讯作者。该课题得到了国家自然科学基金的资助,以及北京大学生命仪器中心(成像平台)和北京大学高通量测序中心的支持。
