近日,北京大学化学与分子工程学院陈鹏/樊新元团队在Chem杂志发表题为“Spatially resolved cell tagging and surfaceome labeling via targeted photocatalytic decaging”的研究论文。是继该团队围绕光催化反应而开发线粒体时空蛋白质组学技术CAT-Prox(J. Am. Chem. Soc. 2021, 18714),以及RNA-蛋白质互作捕捉技术PhotoCAX(Angew. Chem. Int. Ed. 2022, DOI: 10.1002/anie.202202008) 等系列活细胞的光催化工具之后的一个重要进展。本研究中,作者借助抗体的靶向优势,通过抗体偶联光催化剂的策略将光催化剂靶向目标细胞表面,用于多细胞的复杂生物环境中特异性细胞原位标记、膜蛋白组时空解析以及癌细胞选择性可控杀伤,为复杂生物样品的精细时空研究奠定了技术基础(图1)。
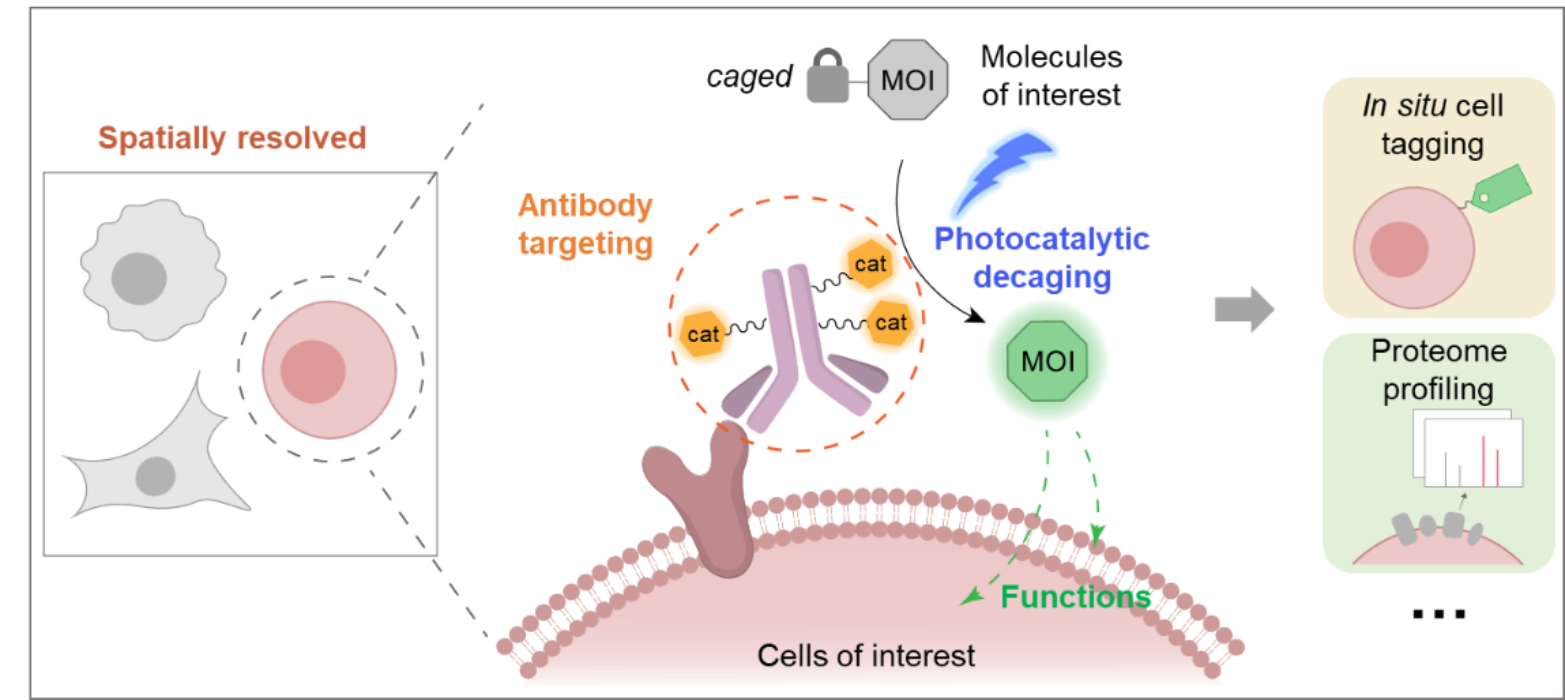
图1. 空间靶向的光催化反应平台CAT-Ex
作者首先设计通过抗体靶向的方式赋予光催化剂在特定细胞表面的定位能力。为此,作者通过点击化学构建了抗体-光催化剂偶联体,并分别通过荧光激活反应和细胞成像证实了抗体-光催化剂偶联体兼具光催化活性与细胞靶向能力。随后,通过细胞体系中的荧光激活实验,作者发现该偶联体在靶细胞表面有明显的光催化反应活性,表明CAT-Ex平台的构建取得初步成功。复杂生命体系中特定细胞的标记与捕获是重要的研究手段。作者通过将CAT-Ex与生物素分子的反应联用,设计了一种光催化介导的细胞选择性共价标记策略。作者以HER2阳性的癌细胞为靶标,将该策略分别在二元、多元以及小鼠肿瘤组织细胞体系中进行了验证,均能够有效地对靶细胞在光控条件下进行生物素共价标记,以方便后续的深度分析(图2)。
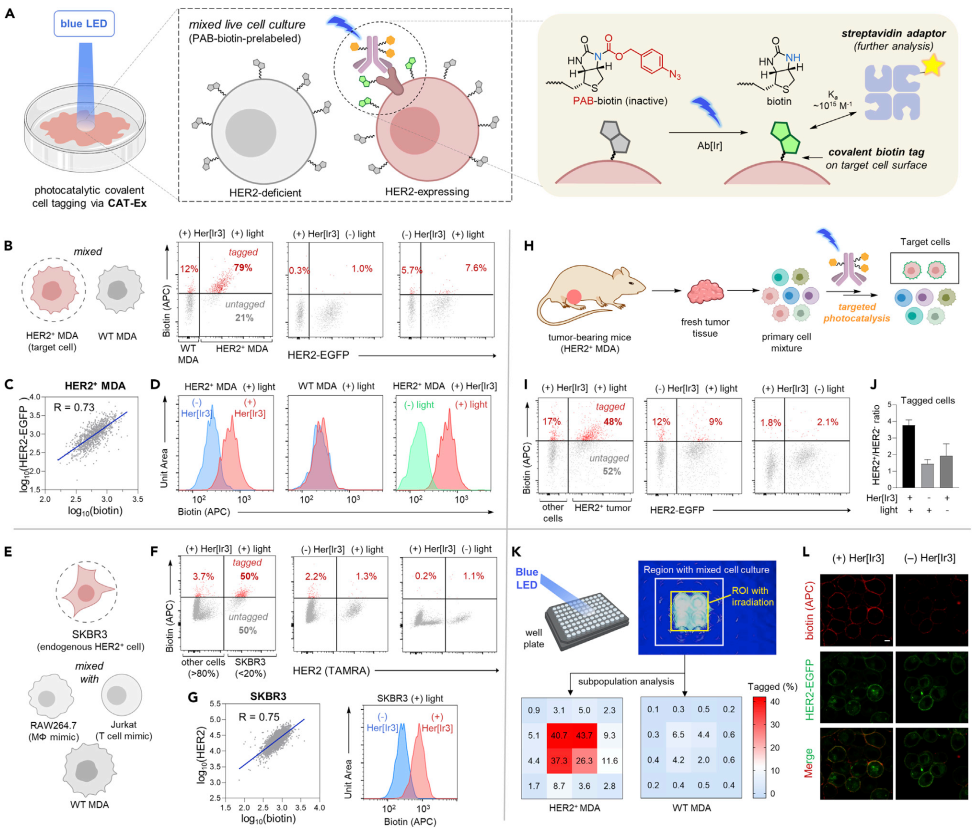
图2. 基于CAT-Ex的细胞选择性原位标记
作者进一步将CAT-Ex与活性中间体—亚甲基醌的光催化激活反应进行联用,发展出了一种新的细胞表面微环境蛋白质组学的研究方法。通过在细胞表面原位激活产生亚甲基醌中间体,目标抗原附近的蛋白质可被标记,以用于组学研究。作者将该方法运用于HER2+MDA和SKBR3乳腺癌细胞表面HER2邻近微环境中蛋白质的标记,并通过串联质谱鉴定到了一系列与HER2有潜在相互作用的膜蛋白(如GLUT1、MRP1等)用于后续的生物学研究(图3)。最后,作者还通过CAT-Ex与前药底物的联用初步阐释了该系统在前药治疗方面的潜力。通过在HER2阳性细胞表面光催化激活释放MMAE前药,作者实现了对特定靶细胞的杀伤。
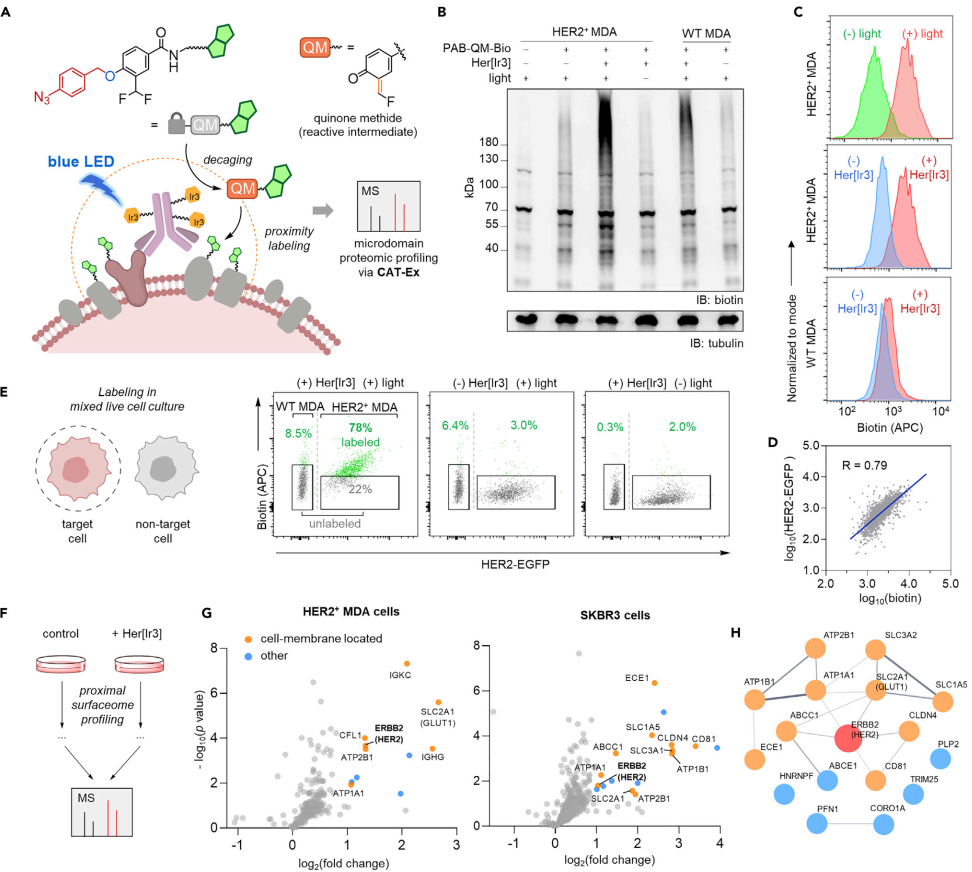
图3. 基于CAT-Ex的细胞表面微环境的蛋白质组学研究
综上,通过抗体靶向策略与光催化生物正交的结合,作者构建了空间靶向的光催化平台CAT-Ex。在复杂体系中,该平台能够将生物正交反应精准定位至特定细胞表面,并通过光控赋予了时空分辨率;通过与多种多样的反应底物联用,CAT-Ex实现了光控细胞选择性标记、细胞表面微环境蛋白质组学以及靶向前药释放等应用场景,体现了该平台的多功能性与通用性。最后,作者也指出蓝光仅适用于活细胞研究,随着正在进行的更长波长光催化反应的开发与持续优化,光催化化学工具在未来有望实现活体动物等更为复杂的生物体系研究,以适应多种多样的生物学应用的需要。
北京大学化学学院、北大-清华生命科学联合中心陈鹏教授和北京大学化学学院樊新元副研究员为该论文的通讯作者。北京大学化学学院博士研究生刘子琦为该论文的第一作者,该工作得到了国家自然科学基金委、科技部、北京分子科学国家研究中心以及北大-清华生命科学联合中心的资助。
