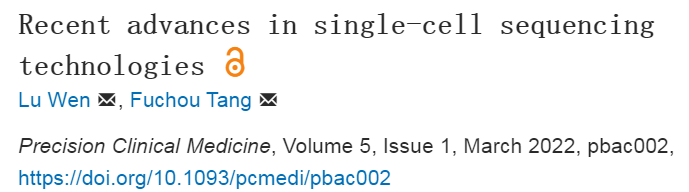
第一、单细胞表观基因组测序技术的最新进展。
表观遗传调控是细胞内基因转录调控网络的核心,其包括染色质状态、三维基因组、DNA甲基化、组蛋白修饰和转录因子结合等多个互为补充、协同调控的层面,以实现在每个细胞中精确调控基因转录表达的目的。近年来单细胞表观基因组测序技术发展迅速,尤其是基于Tn5转座子的染色质可及性测序ATAC-seq技术,因其简便高效而得到大力发展和广泛使用。基于enzyme-tethering策略的CUT&Tag等技术为组蛋白修饰和转录因子结合的单细胞分析提供了新的工具。文章从单细胞染色质状态、三维基因组、组蛋白修饰和转录因子结合、DNA甲基化和染色质状态/转录组双组学五个方面进行了综述。
第二、单细胞基因组测序技术用于谱系追踪的最新进展。
模式动物中的基于转基因标记和单细胞组学测序的谱系追踪技术近年来取得长足进展,但是由于伦理限制,这些技术无法用于人类在体组织器官的谱系追踪。组织器官发育经历了不断的细胞分裂与分化。然而,细胞内DNA复制并非百分百精确,每次细胞分裂都会随机产生少量突变,这些体细胞突变不断积累,可作为识别和追踪细胞谱系关系的独特标志,这就从根本上解决了对人体组织器官细胞的谱系追踪问题。体细胞突变的类型包括单核苷酸变异(SNV)、微卫星序列改变、转座子重复序列改变、拷贝数变异(CNV)和线粒体突变等。近年来,研究通过单细胞分辨率的基因组突变测序分析,初步探索了人类胚胎和器官发育谱系图谱。文章从单细胞基因组测序技术和基因组突变信息两方面进行了综述。
第三、单细胞空间转录组技术的最新进展。
细胞在生物体内所处的空间位置常常对其命运决定和生理功能有重要影响。近年来,空间转录组学技术进展迅速,这些技术尤其适用于无法进行遗传学标记的人类组织样本的研究。空间转录组学包括三类技术:第一类是单分子荧光原位杂交技术,第二类是原位测序技术,第三类是基于原位捕获策略的空间转录组技术。前两类技术具有单细胞分辨率,第三类技术正在接近单细胞分辨率。文章对这些技术进行了综述。
第四、基于第三代测序技术(单分子测序技术)的单细胞组学技术的最新进展。
近年来,包括纳米孔测序和单分子荧光测序在内的单分子长读长测序技术(即第三代测序技术)发展迅速。三代单分子长读长测序技术用于单细胞组学与二代短读长测序技术相比有几方面优点(图1)。其一、单细胞转录组三代测序(单分子长读长测序)方法对全长转录本进行直接测序,从而能够有效地检测可变剪接转录本。汤富酬课题组与王洋团队合作开发了基于三代单分子测序平台的单细胞转录组测序方法SCAN-seq,在小鼠植入前胚胎中检测到了27,250 个未注释转录本(Fan et al., 2020)。其二、单细胞基因组三代测序方法能够有效地检测结构变异,特别是复杂结构变异。虽然二代短读长测序能够有效地检测包括单核苷酸变异和短插入或缺失在内的基因组变异,但是对于包括长片段插入或缺失、基因组重复、异位和环状DNA等在内的基因组结构变异的检测却有很大局限性。汤富酬课题组首次开发了基于三代单分子测序平台的单细胞基因组测序方法SMOOTH-seq,其平均测序读长6000bp(相比于二代测序的300bp读长增加了20倍),从91个K562单细胞中检测到4,790 个缺失事件和 5,589个插入事件, 其中87%的缺失片段和 91% 的插入片段长度小于1kb,检测到的插入事件DNA片段最长达到 7.7kb(Fan et al., 2021)。其三、单分子纳米孔测序方法可以直接检测DNA分子上的表观修饰。三个研究小组最近报道了基于三代单分子测序平台的染色质可及性测序方法(SMAC-seq, Fiber-seq和nanoNOMe)。尽管尚未到单细胞水平,但这些技术展示了研究长距离相邻基因组区域的协同调控关系的巨大潜力和广阔应用前景。
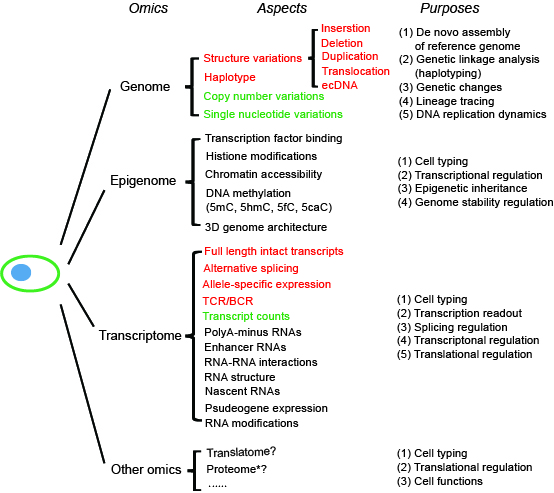
图1 基于第三代单分子长读长测序平台的单细胞多组学。红色与绿色表示已经实现的检测,其中红色表示基于三代长读长测序平台的单细胞多组学方法,与基于二代短读长测序平台的方法相比所具有优势的检测方面
单细胞多组学测序技术近年来进展迅速,但是仍然有诸多可改进之处。单细胞多组学测序技术有很强的普适性。它具备高灵敏度和高精确度但仍有待加强。它的通量、自动化和检测速度近年来迅速提高且成本不断下降,但是仍尚未达到临床检测的强劲需求。尤其对于人类在体干细胞研究,它的时空分辨率还有待大幅提高(图2)。
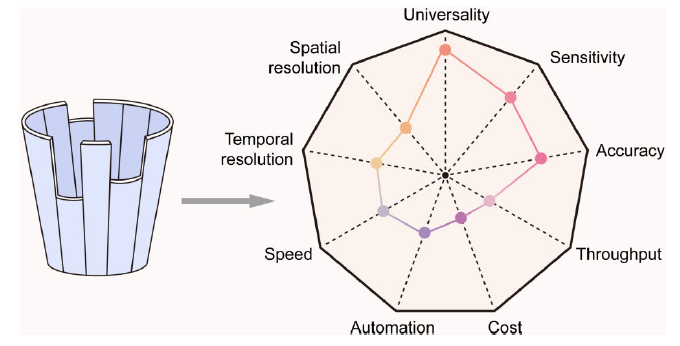
图2 单细胞多组学测序技术的当前状态
汤富酬和文路为该论文的共同通讯作者。该研究项目得到了国家自然科学基金委、北京市科技委的支持。
