中科院理化所王树涛研究员自2010年回国以来,长期致力于癌症早期诊断相关研究。针对如何分离检测血液中痕量循环肿瘤细胞难题,他带领团队围绕界面细胞粘附问题进行了深入的研究。提出了“拓扑匹配与分子识别协同”的细胞粘附界面的研究新思路,探讨了界面微纳结构、软硬度、浸润性等对细胞特异粘附的影响规律,构筑了系列高效特异细胞识别粘附界面(Angew. Chem. Int. Ed. 2011, 50, 3084; Angew. Chem. Int. Ed. 2014, 53, 2915; Adv. Mater. 2015, 27, 310;Nano Lett. 2016, 16, 766; Adv. Healthcare Mater. 2014, 3, 332; NPG Asia Mater. 2013, 59, e63)。通过进一步将智能分子嫁接到多尺度表面上,利用其对外界刺激的响应性(如酶、热、电、糖/pH、光等),实现了对细胞特异粘附和去粘附的无损调控,解决了传统去粘附过程对细胞的损伤(Adv. Mater. 2011, 23, 4376; Adv. Mater. 2013,25, 922; Adv. Mater. 2013, 25, 3566; J. Am. Chem. Soc. 2013, 135, 7603; Nano Res. 2017, 10, 1345)。利用二氧化钛的自清洁特性,实现了对纳米癌症检测芯片的无害化处理(ACS Nano 2015,9,9284)。自2015年以来,通过选择石墨烯为材料,结合结构匹配、软硬度匹配、浸润性调控,获得高的靶向细胞捕获效率(大于92%)与极低的白细胞粘附(Adv. Mater. 2015, 27, 6848),为后面的规模化制备以及临床应用指明了方向。
近日,中科院理化所王树涛、孟靖昕研究员团队与北京大学第三医院马潞林、张树栋教授团队交叉合作,利用马兰戈尼效应以及混合抗体修饰,制备了循环肿瘤细胞检测芯片,实现了高准确率、非入侵性的诊断PSA灰区的前列腺癌。通过与病人穿刺结果对照,将循环肿瘤细胞检测与PSA血液检测结果(PSA,F/T-PSA,PSAD)相结合,并用机械学习的方法进行数据分析,临床病人诊断的敏感性从PSA检测的58.3%提高到91.7%。该项研究提供了一种非入侵的选择,可以实现对PSA灰区的前列腺癌病人的高准确率诊断。
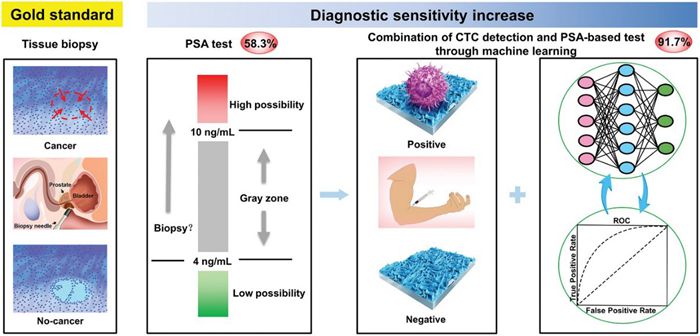
图1. CTC 芯片用于高灵敏、非入侵诊断PSA灰区的前列腺癌的整体思路
根据作为金标准组织活检的结果,PSA测试对于灰区病人展示出了低的敏感性(58.3%)。相比而言,结合CTC检测结果与PSA的结果,并进一步用机械学习分析,发现诊断敏感性提升至91.7%。从而证明该研究方法是组织活检的有益补充。
该研究得到国家重点研发计划和国家自然科学基金、中科院伙伴计划、中科院青促会项目、的大力支持。
论文信息:
Evaporation-Induced rGO Coatings for Highly Sensitive and Non-Invasive Diagnosis of Prostate Cancer in the PSA Gray Zone
Binshuai Wang#, Shudong Zhang#, Jingxin Meng*, Li Min, Jing Luo, Zhongpeng Zhu, Han Bao, Ruhua Zang, Shaohui Deng, Fan Zhang, Lulin Ma*, Shutao Wang*
Adv. Mater. 2021, 33, 2103999 DOI: 10.1002/adma.202103999
论文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202103999
