2020年8月5日,中国科学院动物研究所刘峰研究员团队与同济大学张勇教授团队合作在BLOOD杂志发表了题为Smarca5 mediated epigenetic programming facilitates fetal hematopoietic stem and progenitor cell development in vertebrates的论文。该工作发现:在产生和扩增/分化等不同发育阶段的造血干祖细胞中,染色质可接近性和转录组存在动态变化。深入机制探索发现,染色质重塑因子Smarca5通过与核仁蛋白Nucleolin相互作用,促进染色质重塑,调控造血相关的转录因子与基因组结合,进而促进造血干祖细胞发育。
研究人员利用模式动物斑马鱼,聚焦染色质可接近性和转录组,研究胚胎期两个造血组织中造血干祖细胞的基因表达动态调控。通过对斑马鱼AGM区新产生的造血干祖细胞以及处于扩增/分化阶段的CHT区造血干祖细胞进行ATAC-seq和 RNA-seq分析,发现染色质开放性在AGM区和CHT区造血干祖细胞中存在动态变化,启动子区的染色质开放程度对于基因的转录影响更为明显。与AGM区新生造血干祖细胞相比,造血相关基因的染色质开放性在CHT区造血干祖细胞中更加富集。同时,造血相关基因的表达水平在CHT区造血干祖细胞中更高。以上结果暗示,CHT区造血干祖细胞具有更加稳定和特异的造血能力。
为了寻找调控造血干祖细胞发育过程中染色质状态变化的关键染色质重塑因子,研究人员结合染色质重塑因子在AGM区和CHT区造血干祖细胞中的表达以及基因敲低/敲除实验,证实Smarca5通过调节染色质可接近性促进CHT区造血干祖细胞的增殖和分化。此外,通过质谱检测和功能性实验验证,研究人员发现核仁蛋白Nucleolin可以与Smarca5相互作用,并调控CHT区造血干祖细胞扩增/分化。进一步机制研究证明,Nucleolin有助于Smarca5介导的染色质重塑,进而影响与造血干祖细胞增殖和分化相关的转录因子(包括:Klf1和Spi1)与基因组的结合。例如:Smarca5缺失影响了Spi1在bcl11ab启动子区的结合,导致bcl11ab表达下调, 进而造成CHT区造血干祖细胞发育缺陷。
综上所述,该研究揭示了表观遗传调控在各造血组织中不同阶段的造血干祖细胞发育的重要性。该研究得到了国家重点研发计划、国家自然科学基金以及中国科学院的资助。
原文链接:https://doi.org/10.1182/blood.2020005219
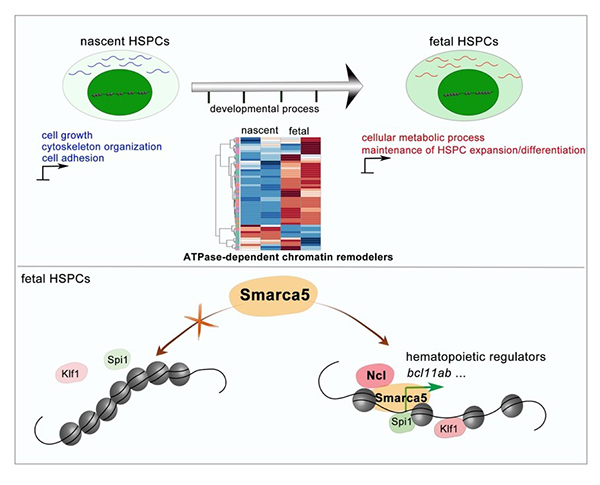
Smarca5介导的表观遗传调控促进胚胎期造血干祖细胞的发育
图注:在产生和扩增/分化等不同发育阶段的造血干祖细胞中,染色质可接近性和转录组存在动态变化,并伴随着染色质重塑因子的动态表达。其中,染色质重塑因子Smarca5通过与核仁蛋白Nucleolin相互作用,促进染色质重塑,调控造血相关的转录因子(包括:Klf1和Spi1)与基因组结合,进而促进造血干祖细胞发育。例如:Smarca5缺失影响了Spi1在bcl11ab启动子区的结合,导致bcl11ab表达下调, 进而造成CHT区造血干祖细胞发育缺陷。
| 附件下载: | |
