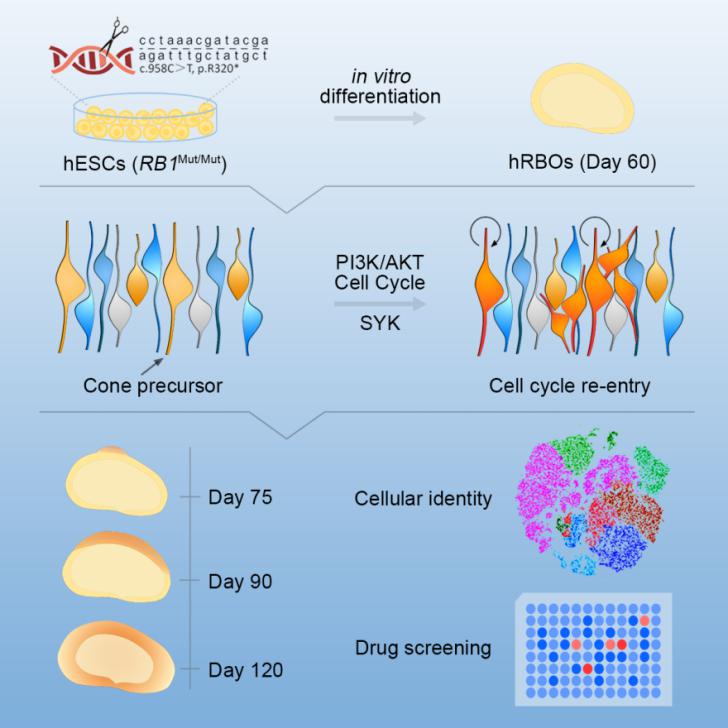
视网膜母细胞瘤是最常见的眼内恶性肿瘤,在2-3岁儿童高发,全球平均生存率只有30%。长期以来,其肿瘤细胞起源尚无定论,直接影响临床治疗及时间窗口。解决这一问题的关键在于建立适合长期培养、实时追踪、高度保真的人类恶性肿瘤模型。
本研究中,研究人员将人类胚胎干细胞分别进行RB1基因的靶向高频突变(RB1Mut/Mut)及敲除(RB1-/-)之后,发现多能性及细胞周期等均未变化。通过体外分化诱导技术使其发育成为视网膜类器官(Retinal Organoids)。在定向分化第60天前后出现了明显的瘤体形成。此类瘤体细胞在基因表达谱、分子信号通路、甲基化谱、标记蛋白及超微结构等方面表现出高度一致的视网膜母细胞瘤特征,且将其移植到动物眼内后可成瘤。单细胞RNA测序等分析显示,此肿瘤起源于正在成熟的视锥前驱细胞(maturing cone precursor),同时表达ARR3和Ki67(正常情况下ARR3+视锥前驱细胞不再表达Ki67)。随后,研究者基于其显著激活的PI3K-Akt信号通路特征,通过靶向该通路的激动剂SYK,成功筛选到两个候选新药分子。
该研究通过团队长期积累的干细胞分化视网膜技术,首次在培养皿中造出了视网膜母细胞瘤,揭开了最常见人类眼内恶性肿瘤的细胞起源与治疗靶点,为癌症起源和新药筛选开辟了全新的路径,也为人类其他恶性肿瘤的组织细胞起源与治疗靶点研究提供了重要借鉴。
该研究得到国家自然科学基金等项目的支持(81522014,81970838)。

金子兵,教授、博士生导师,现任北京市眼科研究所所长。长期从事遗传性眼病的诊治及研究,主要研究技术为诱导多能干细胞分化视网膜及再生治疗研究和正反向临床遗传学。目前担任全国防盲技术指导组副组长、北京市眼科学会常委、中华医学会眼科分会学组委员、中国遗传眼病联盟常务理事、中国医师协会青委及遗传眼病学组副组长等。获批国家自然科学基金面上及优青项目、科技部、973课题和国家重点研发计划子课题、及北京市自然科学基金重点专题等项目。发表高水平论文百余篇。获中国青年科技奖、日本JRPS研究奖、中国驻日大使奖等,以第一完成人先后获省部级自然科学奖二等奖和一等奖。任Experimental Eye Research等多个期刊编委或副编辑,《眼科》杂志执行主编。
