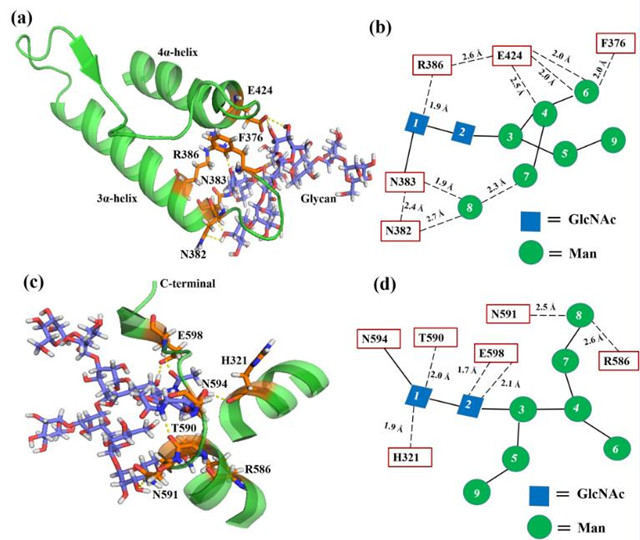
图1 天然糖基化的“连接臂”作用机制
在真核生物中,N-糖基化是一种重要的翻译后修饰,对调控蛋白质的稳定性具有至关重要的作用。然而,生物体内自发的N-糖基化随机性较强,大多的糖基修饰不能处于稳定蛋白质构象的最佳位点,导致其对蛋白质稳定性的提升作用不显著,甚至不合适的N-糖基还会降低酶的稳定性,大大限制了其在蛋白质稳定性改造中的应用。
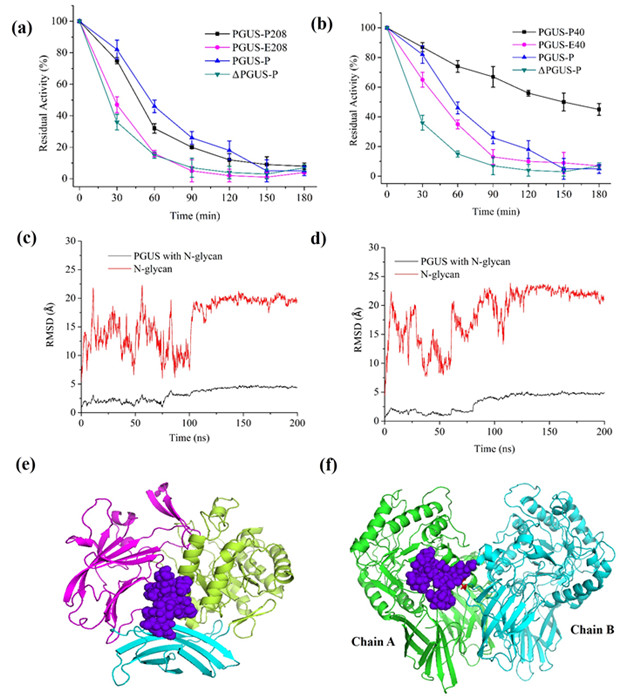
图2 人工设计的“糖桥”和“糖卡”构象显著提高PGUS的热稳定性
北京理工大学化学与化工学院李春教授课题组在前期完成晶体结构解析的真菌β-葡萄糖醛酸酶(PGUS,同源四聚体结构)为模型蛋白,并将其在毕赤酵母(能够在蛋白质的特定位点引入高甘露糖型糖链)中异源表达(PGUS-P),验证了蛋白质内源的Asn383和Asn594位点的糖基化对PGUS-P的稳定性有显著影响。通过计算机模拟与实验相结合的方法,揭示了PGUS-P的两个內源N-糖基功能类似于“连接臂”,能将空间上距离相近的超二级结构域相连,使得其局部结构更加紧凑,从而提高了蛋白质的整体稳定性(图1)。以此为启发,研究人员通过对PGUS的晶体结构分析,在超二级结构域、结构域、亚基界面间设计了N-糖基化位点,进一步提高了PGUS-P的动力学、热力学稳定性。酶学性质表征并结合全原子分子动力学模拟结果表明,在结构域界面间的Asn208位糖链和周围二个结构域产生的作用力,形成了“糖桥”构型,将蛋白质在70°C下的半衰期提高了2.7倍,去折叠自由能提高了8.4 kJ/mol;而在亚基界面间的Asn40位糖链通过和相邻亚基的作用,形成了“糖卡”构型,将热稳定性提高了7.1倍,去折叠自由能提高了14.6 kJ/mol,同时酶的催化效率也提高了1.7倍(图2)。
研究人员不仅从蛋白质多结构层次水平的角度对糖链和蛋白质之间的相互作用提供了独特的见解,而且促进了N-糖基化的理性设计,使其成为提高蛋白质稳定性的通用技术。相关研究发表在Journal of Physical Chemistry Letters(2018, 9, 4638?4645,IF="8.709)杂志上,该文章的第一作者是北京理工大学的冯旭东预聘助理教授和王小艳博士。
生物转化与合成生物系统研究团队(iBT-SynBios)自2005年在北理工成立以来,专注于抗逆生物催化和合成生物学的研究,已在Metab Eng、Curr Opin Biotech、AIChE J、J Phys Chem Lett、J Biol Chem、Chem Eng Sci、Chem Eng J、ACS Synth Biol、Nucleic Acids Res、Ind Eng Chem Res和Bioresource Technol等生物化学工程与化学工程领域的顶级期刊上发表文章120余篇,获授权发明专利26项,获省部级科技奖励5项。课题组致力于利用合成生物技术和酶催化技术革新传统微生物发酵与生物转化模式,将继续开展天然产物合成途径的构建、路径的优化与精确调控和生物过程集成的研究,为实现绿色、高效的药物、生物基化学品的生物制造提供新思路和新方法。
文章链接:https://pubs.acs.org/doi/10.1021/acs.jpclett.8b01570
